血液腫瘤科/細胞治療中心 陳駿逸醫師
近年來,腎細胞癌 (RCC) 的全身性治療方案已有顯著的近展,標靶治療和免疫檢查點抑制劑(單獨或合併使用)均已進入臨床實務的標準做法。過繼性免疫細胞療法近年來徹底改變了許多癌症的治療,有望進一步推進腎臟細胞癌的治療。
腎臟細胞癌使用過繼性細胞免疫療法領域的最新臨床前和臨床進展,聚焦的重點在於淋巴激素活化的殺手 (LAK) 細胞、細胞激素誘導的殺手 (CIK) 細胞、腫瘤浸潤性 T 細胞 (TIL)、TCR 工程化 T 細胞、嵌合抗原受體 (CAR) T 細胞以及樹突細胞疫苗接種策略。此外,新興的細胞產品,包括 CAR NK 細胞、CAR 巨噬細胞以及 γδ T 細胞也有在腎臟細胞癌的研究。
迄今為止,專家認為過繼性的免疫細胞療法在轉移性腎細胞癌患者中取得較大進展的領域,包括術後輔助CIK免疫細胞治療和抗CD70的 CAR-T細胞治療。
專家認為需要進行從實驗室到臨床的全方位研究,以克服過繼性的免疫細胞療法在腎細胞癌治療中的局限性,主要目標是提高免疫細胞產品的安全性,優化其抗腫瘤活性,並生產可用於臨床的現成產品。
過繼性的免疫細胞療法(adoptive cellular therapy)的生物特性
過繼性的免疫細胞療法包含多種異質性產品。
首先,免疫細胞可以透過週邊血液或切除的腫瘤來獲取。其次,不同的免疫細胞,包括:αβT細胞、γδT細胞、NK細胞、巨噬細胞和樹突細胞,可用於人體之過繼轉移。
第三,每種產品可能包含不同比例的免疫細胞亞群(例如:CD4+:CD8+ T細胞比例),其擴增能力、分化狀態和衰竭的程度也各不相同。
第四,可以產生患者來源的自體產品或來源捐贈者的同種異體體現成產品。
第五,分離後的免疫細胞可以進行體外擴增(例如:LAK細胞、CIK細胞、大量TIL細胞)、富集用於抗腫瘤特異性(例如:新抗原反應性TIL細胞)或基因工程畫(例如:TCR工程化T細胞、CAR-T細胞、CAR-NK細胞和CAR-巨噬細胞)。下圖展示了過繼性細胞免疫療法的主要形式。毫不奇怪,每種過繼性細胞免疫療法都有其特定的優點和本身的局限性,這點留待之後會論述。
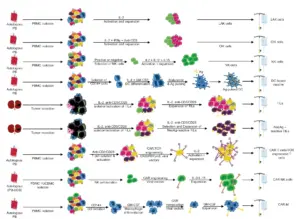
圖1. 迄今為止,已開發出多種過繼性的免疫細胞療法。雖然大多數過繼性細胞療法使用周邊血或臍帶血作為細胞來源,但淋巴結或腫瘤組織也可分別用於產生LAK細胞和TIL細胞。在大多數以T細胞為基礎的過繼性的免疫細胞療法中,患者在過繼移植前會接受支持性IL-2激素的治療和淋巴球清除性化療。
PB:週邊血;PBMC:週邊血單核細胞; DC:樹突細胞;Ag:抗原;NeoAg:新抗原;UCB:臍帶血;UCBMC:臍帶血單一核細胞。
關於 LAK 和 CIK 細胞
LAK 細胞是由從週邊血液或非轉移性的淋巴結中,分離出的自體淋巴細胞組成,這些細胞在體外使用重組人類 IL-2 活化。
LAK 細胞製劑中可以同時辨識 T 細胞、NK 細胞和 NKT 細胞群。 LAK 細胞通常表達 CD3、CD56 和 NKG2D 等 NK 細胞的標記物,並具有 HLA 非依賴性的殺傷能力。 輸注LAK 細胞後,需要給患者靜脈或皮下注射高劑量 IL-2 以維持其活性,但這可能導致嚴重的副作用,包括肺水腫或呼吸衰竭。
CIK 細胞是具有混合 T 細胞、NK 細胞和 NKT 細胞表型的細胞。它們透過將自體或同種異體的週邊血單核細胞與 IFN-γ、IL-2 和抗 CD3 單株抗體一起孵育,以刺激有絲分裂而產生CIK 細胞。
CIK 細胞製劑主要含有 CD3+/CD56− 細胞,同時 CD3+/CD56+ 細胞和 CD3−/CD56+ 細胞的比例也各不相同。 CD3+/CD56+ 細胞群包括了: NKT 細胞和表達 CD56 的活性T 細胞,都具有最高的細胞毒殺力,這在臨床等級的產品中應具有較高的代表性(佔單核細胞總數的 ≥20%)。
CIK 細胞具有 HLA 限制性和非 HLA 限制性的抗腫瘤活性。從機制上講,CIK 細胞透過 Fas 訊息傳遞路徑去誘導腫瘤細胞凋亡、活化 C 型凝集素受體 NKG2 家族的受體,並透過產生 IFNγ 和 TNFα 來刺激先天性和適應性的免疫,從而發揮其細胞毒活殺的性。
與 LAK 細胞不同,CIK 細胞輸注人體後不需要 IL-2 支持。 CIK 細胞的主要副作用包括發燒、發冷、疲勞、頭痛和皮疹。
整體而言,LAK 和 CIK 細胞的臨床等級的製劑,生產相對快速簡單。當存在病毒抗原時,T 細胞/NK 細胞雙介導的抗癌活性可能特別有利。 LAK 和 CIK 細胞的臨床研究主要在亞洲國家進行,關於其在西方人群中之潛在抗腫瘤活性的確鑿證據尚不清楚。支持 LAK 和 CIK 細胞臨床抗腫瘤活性的證據等級,在全球範圍的要求下應該算是比較低。
腫瘤浸潤淋巴細胞( TILs)
TILs 包含一群異質性的免疫細胞,它們位於腫瘤的微環境中,並富集了抗癌的特異性。它們主要由 CD8+ 和 CD4+的T細胞組成,以及少量的 NK 細胞、B 細胞和 NKT 細胞。大多數 TILs 處於終末分化的階段,並且由於暴露於充滿腫瘤抗原的微環境、而表達出抑制性或耗竭相關分子;其中少數是旁觀者細胞,其特徵是 CD39- 表型。目前已開發出一些方案來富集具有抗癌特異性的細胞產物。臨床規模的 TILs 製劑的製備,包括從切除的腫瘤中分離淋巴細胞,然後進行淋巴細胞的擴增和活化。儘管近年來已開發出許多方案,但體外刺激淋巴細胞增殖以達到具有臨床意義的大量TIL(100-1000億),通常使用IL-2和飼養細胞或抗CD3包覆的磁珠所進行。然而,在IL-2的壓力下,分化程度較低的細胞克隆的選擇性生長會導致耗竭的癌症特異性T細胞的負選擇,使T細胞受體庫會偏離新抗原反應性群體,從而限制了臨床級TIL產品的抗腫瘤活性。
TIL本質上是多克隆的,可以識別多種抗原,包括:腫瘤相關抗原、癌睪丸抗原、病毒抗原、新抗原(亦即由腫瘤特異性體細胞突變產生的抗原),以及未知抗原和旁觀者抗原。由於對自身抗原具有高親和力的天然T細胞受體,會在胸腺中受到負向的選擇,而靶向腫瘤相關抗原的TIL往往具有較低的親和力,因此其抗腫瘤活性大多弱於新抗原反應性的T細胞。高通量基因定序技術的出現以及計算生物學的最新進展,為新抗原反應性T細胞的鑑定、選擇和擴增,開創了可行性。新抗原反應性TIL的輸注,最近研究已顯示出對多種上皮癌的顯著療效,目前正在努力利用循環性(而非腫瘤浸潤)新抗原反應性的淋巴細胞,來產生富含抗腫瘤特異性的細胞製劑。
使用淋巴細胞清除化療(即Fludarabine合併Cyclophosphamide)對患者進行預處理,可以顯著提高過繼性治療的療效,這可能是由於 Treg 和其他免疫抑制細胞數的量減少所導致。
在接受非清髓性化療的患者中,過繼性 T 細胞在過繼數月後,循環的 CD8+ T 細胞仍可佔80%。接受 TIL 治療的患者需要使用 IL-2 來維持淋巴球的增生。 TIL 的副作用主要與淋巴球清除和 IL-2的使用有關,通常是可以控制。
與 LAK 或 CIK 細胞相比,TIL 發揮的腫瘤細胞殺傷活性具有高度的特異性,可針對多種不同的抗原表位。雖然免疫耐受阻礙了針對腫瘤相關抗原的TIL策略的發展,但針對癌睪丸抗原、病毒抗原或新抗原的TIL產品的製造,可說是既費力又耗時。且只有一小部分癌症患者能夠獲得具有臨床意義的TIL細胞的數量。
TCR工程化的T細胞
透過基因工程,可以將周邊血液中的T 細胞的特異性,重定向到腫瘤抗原。在白血球的分離技術中,T 細胞經過慢病毒或逆轉錄病毒轉導或用 CRISPR/Cas9 編輯,以高親和力和親和力的表達,去靶向特定腫瘤抗原的 TCR。然後在 IL-2 的存在下,擴增TCR工程化的T細胞,並將其重新輸回患者體內。為了促進幹細胞樣 -T 細胞的擴增,並提高其在人體內的持久性,有人提出使用 IL-7/IL-15 或 IL-21 代替 IL-2的激素支持。在輸注 TCR 工程化的 T 細胞之前,需要進行淋巴細胞清除式的化療,隨後輸注高劑量 IL-2,已證實與更好的臨床結果有相關。
早期嘗試利用 TCR 工程化的 T 細胞針對癌組織分化抗原(即 CEA),結果經常出現“靶向、脫腫瘤”的副作用,限制了這些產品的臨床應用。隨後,針對表現出腫瘤限制性表達模式的癌睾丸抗原(即 NY-ESO-1、MAGE-A3、MART-1)的 TCR 工程化 T 細胞之研究,成功實現了臨床療效,且無嚴重副作用。
TCR 工程化之T 細胞的抗癌活性,會受到 HLA(人類白血球抗原) 的嚴格限制。這縮小了現成製劑的臨床使用範圍。此外,內源性和外源性 α 和 β 鏈的錯誤配對,也可能會導致新的不必要的特異性。
CAR-T細胞治療
CAR-T 細胞是經過基因工程改造的 T 細胞,能夠以非 HLA 的限制性方式識別特定性的腫瘤抗原。
CAR 是具有模組化結構,由胞外抗原識別結構域、鉸鏈區、間隔區和跨膜結構域以及胞內啟動結構域所組成。胞外結構域通常由源自腫瘤反應性抗體 (Ab) 的單鏈可變片段 (scFv) 構成,根據其結構,CAR 的胞外結構域還可以賦予針對碳水化合物或脂質的靶向特異性,從而突破了傳統 T 細胞表位的限制。然而,CAR只能識別表面抗原,而TCR也可以靶向HLA呈遞的胞內肽。
鉸鏈結之構域調節胞外結構域的柔韌性,從而控制CAR的功能。它通常由免疫球蛋白、CD8或CD28衍生肽所構成。α螺旋跨膜結構域將CAR錨定在細胞膜上,並將細胞外區的活化信號傳遞到T細胞,導致胞內結構域的強直啟動,進而驅動T細胞增殖和活化。
雖然 CAR 的觀念化最早可以追溯到 1987 年,但監管機構首次核准卻花了 30 年時間。迄今為止,已經開發了第五代 CAR。第一代 CAR 是由與 TCR 的 CD3ζ 鏈融合的 scFv 結構域組成。第一代 CAR T 細胞表現出較低水平的增殖、持久性和細胞毒殺性,缺乏生理上促進 T 細胞活化的共刺激信號。
而第二代和第三代 CAR 分別包含一個或兩個共刺激分子。CD28、4-1BB、OX40、CD27、ICOS 或 DAP10 是 CAR 設計中最常用的共刺激分子。值得注意的是,共刺激分子彼此並不等同,並且據報導,它們在反應動力學、持久性和毒性特徵方面存在臨床相關的差異。
第四代和第五代 CAR-T 細胞統稱為下一代 CAR-T 細胞。第四代 CAR-T 細胞,也稱為 T 細胞重定向通用細胞激素之殺傷 (TRUCK),可以產生 IL-12、IL-15 或 IL-18 等細胞激素,以侵入腫瘤微環境,並提高持久性和細胞毒殺性。
第五代 CAR-T 細胞包含有一個胞內結構域(即 IL2Rβ 盒),能夠刺激由細胞激素之生理誘導的信號,從而提高細胞毒殺性和持久性。自殺安全開關可以提高 CAR-T 細胞的安全性。自殺基因(即 Caspase 9)確實可以在施用特定藥物(通常是抗生素)後促進 CAR-T 細胞的快速清除,這種安全機制可以幫助治療那些罕見的危及生命的毒性病例。
CAR-T細胞的製備過程涉及多個步驟。白血球分離後,T細胞可以透過病毒或非病毒的策略進行基因工程改造。慢病毒和逆轉錄病毒載體均已用於轉導T細胞以表達CAR。儘管病毒轉導具有較高的基因轉移效率,並能確保CAR永久整合到宿主細胞基因組中,但已觀察到病毒轉導對T細胞的擴增有負面影響,可能導致產生的細胞製劑不足,而無法用於輸注。此外,有插入性突變和惡性轉化的風險,最近已報告了CAR陽性的淋巴瘤病例。
由於大多數病例報告的突變在CAR-T細胞輸注之前就已存在,因此CAR整合是否可以被視為惡性轉化的驅動因素仍有待進一步研究。美國食品藥物管理局 (FDA)之不良事件通報系統 (FAERS) 的最新分析顯示,在美國 CAR-T 細胞療法不良事件報告中,4.3% 記錄了第二原發性惡性腫瘤(主要為髓系腫瘤和 T 細胞腫瘤)。 CAR-T 細胞的非病毒生成方法,包括基因編輯策略(例如: CRISPR/Cas9 或 TALEN)、基於轉座子的系統(例如: Sleeping Beauty、PiggyBac 或 Tol2)、mRNA 電穿孔以及奈米醫學策略。 CAR-T 細胞輸注前是否需要進行淋巴球清除性化療尚有爭議。
CAR-T 細胞療法在實體癌症的臨床研究,遠不如血液系統惡性腫瘤那麼成功。一些障礙嚴重地限制了 CAR-T 細胞對實體癌的療效。首先,雖然CAR-T細胞在血液系統惡性腫瘤中會在血液和/或淋巴系統中遇到目標,也就是癌細胞,但它們需要在實體癌症中進行運輸、並充分浸潤到腫瘤部位。
其次,實體瘤的特徵是酸性、缺氧、免疫抑制的微環境,這會大大改變CAR-T細胞的免疫代謝,對其存活、增殖、分化和衰竭產生負面的影響。
第三,動態免疫編輯過程和抗原逃脫機制會損害CAR-T細胞的活性。值得注意的是,CAR標靶的缺失是CAR-T細胞治療實體腫瘤的常見逃脫機制。最後,腫瘤相關抗原(即CAR-T細胞最常標靶的抗原,例如CEA、EGFR、HER2、SSTR等)的特異性通常較低,因此存在潛在的標靶/脫靶之毒性風險。
樹突細胞疫苗
樹突細胞是專業的抗原呈現細胞,能夠刺激先天性和適應性免疫系統。白血球分離後,分離CD14+單核細胞,並在體外以IL-4和GM-CSF培養,以促進其向樹突細胞分化。然後,加入TNFα、IL-1β、IL-6和前列腺素E2誘導樹突狀細胞的成熟。分化成熟後,將抗原(例如:mRNA、短肽、蛋白質和腫瘤裂解物)負載於樹突細胞,然後注射到患者體內。給藥途徑包括皮下、皮內、結內或靜脈注射。目前尚不清楚多次注射是否比單次注射更有效。樹突細胞一旦注射,就會以HLA限制的方式來驅動抗原反應性淋巴細胞的擴增和激活,從而引發免疫記憶。癌症免疫編輯導致了缺乏高親和力抗原的腫瘤細胞的免疫選擇以及HLA缺失,這被認為是人類樹突狀胞疫苗接種後,腫瘤細胞常見的逃脫機制。
新興的細胞產品
創新細胞產品在過繼性細胞免疫治療領域正受到越來越多的關注。 NK 細胞是天然淋巴球,其特徵為 CD3−/CD56+ 表型。它們可以在 CD3+ 細胞耗竭後從週邊血液單一核細胞 (PBMC) 擴增。 IL-2 或 IL-15 通常用於促進 NK 細胞的體外擴增和活化。 NK 細胞利用不同的非 HLA 限制性機制誘導癌細胞死亡,這些機制包括穿孔素和顆粒酶顆粒的胞吐、死亡誘導配體的表達以及透過 CD16 受體的抗體依賴性細胞毒殺作用。
與T細胞不同,NK細胞能夠辨識缺乏HLA分子的癌細胞,其機制是利用腫瘤細胞上暴露的壓力誘導配體(MICA、MICB、B7-H6、RAET1E等)與NK細胞活化受體(NKG2D、DNAM1、CD16等)的結合。使用半相合NK細胞進行同種異體治療是可行的。
迄今為止,擴增NK細胞的臨床試驗結果令人失望。 CAR-NK細胞最近才被開發出來,其臨床試驗仍處於起步階段。由於缺乏HLA的限制,CAR-NK細胞的現成生產是可能的,儘管臨床級NK細胞分離、擴增和轉導方案還需要更優化。
與NK細胞類似,γδT細胞(即攜帶TCRγ鍊和δ鏈的淋巴細胞)會以HLA非依賴的方式發揮其活性,從而推動了同種異體細胞療法的發展。與數量更豐富的αβ T細胞相比,γδ T細胞表現出優先組織歸巢的特性,並且能夠透過其NKG2D受體去識別癌細胞等壓力細胞。目前,γδ T細胞或工程化γδ T細胞的臨床研究正在進行中。
在髓系細胞中,巨噬細胞通常在腫瘤床中被募集。巨噬細胞具有獨特的極化免疫微環境的能力,其固有的對基因操作的抵抗力最近已被突破。第一代和第二代CAR-T巨噬細胞分別含有CD3ζ和CD3ζ-TIR(toll樣受體4胞內toll/IL-1受體),現已成功建構。
談過繼性細胞療法在腎細胞癌的臨床應用
過去三十年,過繼性細胞免疫療法在腎細胞癌治療中越來越受到重視。大多數臨床試驗主要評估過繼性轉移策略的安全性,因此,新一代研究旨在探討免疫細胞療法在轉移性和輔助性治療中的抗腫瘤潛力。表1總結了已完成的腎細胞癌患者過繼性胞免疫細療法之研究的結果。
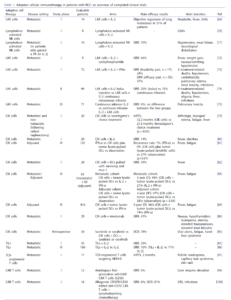
LAK 和 CIK 細胞
LAK 和 CIK 細胞在腎細胞癌患者的臨床試驗,主要在亞洲國家進行研究。一項開創性研究對 14 例轉移性腎細胞癌患者每週輸注一次或兩次的LAK 細胞和 IL-2。14 例患者中有 3 例觀察到肺轉移灶在治療後呈現客觀性的消退,100% 的患者報告了在治療中出現的流感樣症狀,例如頭痛、發燒和發冷。
在隨後的研究中,9 例轉移性的腎細胞癌患者,接受了兩個療程的淋巴激素活化的 NK 細胞(即 LAK 細胞的 NK 部分)和 IL-2 。該治療的整體耐受性良好。在此基礎上,有人研究了 10 例經過單予療程的IL-2 治療後獲得部分緩解的淋巴激素活化的 NK 細胞。
在這群經過嚴格挑選的患者中,單次輸注細胞產品後,有4 例的腫瘤完全緩解和 3 例的腫瘤完全緩解。
一項針對 9 例晚期腎癌患者的研究也報告了類似的結果,該研究使用了 LAK 細胞、IL-2 和cyclophosphamide聯合標靶藥物。經過 4 週的治療,確實記錄了 3 例之腫瘤完全消失和 3 例之腫瘤部分消失。
一項針對 LAK 細胞、高劑量 IL-2 和 IFN-α 的兩階段研究共招募了 72 例轉移性腎癌患者。在研究的可行性部分,觀察到腫瘤客觀反應率為 24%。在研究的有效性部分,招募的 51 名可評估患者中,記錄了 6 例腫瘤完全消失和 13 例患者之腫瘤部分消失,治療有效率為 37%。中位反應持續時間為 11 個月,報告了 3 例發生治療相關死亡病例。
在一項針對 94 例晚期轉移性腎癌患者的2期研究中,LAK 細胞與高劑量 IL-2 一起輸注,IL-2 以每日三次推注或 24 小時持續輸注的形式給藥。兩組的客觀緩解率相似(IL-2 推注組為 20%,IL-2 持續輸注組為 15%)。
隨後在一項第三期試驗中研究了 LAK 細胞輸注,對晚期轉移性腎癌患者臨床結果改善的相對貢獻,該試驗將 71 例晚期轉移性腎癌患者隨機分配接受 IL-2 或 IL-2 加 LAK 細胞治療。兩組之間的反應和存活期並沒有差異。
一項統合分析研究了基於IL-2的晚期腎細胞癌患者的治療方案,結果顯示IL-2合併LAK細胞治療會優於IL-2單藥治療。目前尚未證實輸注LAK細胞的數量與安全性或療效結果之間存在著關聯性。全身輸注LAK細胞主要會在肺部積聚,而局部動脈輸注細胞製劑可以改善腫瘤床歸巢的效應。整體而言,關於LAK細胞治療晚期轉移性腎癌患者的療效數據似乎相互矛盾。相關證據大多來自效力不足的研究,這些研究通常使用非標準化的腫瘤療效評估標準,缺乏相關的對照組,並且該研究是在晚期轉移性腎癌有效治療方法尚不成熟的時代進行的。
目前尚無針對晚期轉移性腎癌患者使用LAK細胞的臨床試驗正在進行中。整體而言,上述結果無法與目前以免疫療法為基礎的聯合療法為代表的標準治療方案所能達到的效果相提並論。
許多研究已經評估了 CIK 細胞的單獨使用或與樹突細胞、免疫檢查點抑制劑或與標靶藥物,聯合使用在晚期轉移性腎癌患者中的安全性和有效性。在一項自體 CIK 細胞添加 IL-2 的研究中,20 例接受根治性腎臟的切除術轉移性;或非轉移性透明細胞之晚期轉移性腎癌患者被隨機分配接受過繼性 CIK 細胞治療或研究者選擇的治療。 CIK 細胞組的中位無疾病之惡化存活期 (PFS) 會明顯長於對照組(分別是32 個月或 22 個月),但整體存活期則是無差異。未見超過3 級不良事件的通報。一項針對 29 例轉移性腎癌患者的研究,調查了 RetroNectin 活化的 CIK 細胞、加 IL-2 的輸注。記錄的治療有效率為 14%,臨床受益率 (CR+PR+SD) 為 62%。 1 年的存活率為 83%,攜帶低比例髓系抑制細胞的患者其存活期較長。
一項隨機對照試驗在 137 例根治性手術切除術轉移性腎癌患者中比較了輔助 IFN-α 或 5 個療程,術後 CIK 細胞的治療會加腫瘤裂解物脈衝道樹突狀細胞(研究組)與觀察組(對照組)的療效。研究組的復發率顯著低於對照組,但 CIK 樹突狀細胞和 IFN-α 之間沒有差異。
在另一項研究中,28 位晚期透明細胞之轉移性腎癌患者接受了以編碼 survivin 和 muc-1 RNA 脈衝式的 CIK 細胞和樹突細胞治療。在沒有嚴重不良事件的情況下,ORR 為 39%(CR:14%;PR:25%)。一項針對 60 名可手術 RCC 患者和 62 名不可手術 RCC 患者的隨機對照試驗研究了自體 CIK 細胞加腫瘤裂解物脈衝樹突狀細胞在輔助和轉移環境中的作用 [引文 83]。在術後群組中,對照組患者未接受任何輔助治療,而轉移組(研究組和對照組)的所有患者均接受了 IL-2 和 IFN-α。在術後患者中,研究組和對照組的 3 年無疾病存活率 (DFS) 有顯著差異(分別為 97% 和 58%;p = 0.04)。在轉移性患者中也觀察到 3 年 OS 的類似改善(分別為 49% 和 21%;p = 0.01)。過繼轉移未引起 3 級或 4 級不良反應。隨後對 410 例接受手術的 RCC 患者的研究也得到了類似的結果 [引文 84]。與 IFN-α(分別為 83% 和 74%)相比,輔助輸注 CIK 細胞加負載腫瘤裂解物的樹突狀細胞可改善 3 年和 5 年 OS(分別為 96% 和 96%)。
CIK 細胞也已與標靶藥物或免疫檢查點抑制劑合併使用進行了研究。在一項針對 34 例接受根治性腎切除術之轉移性腎癌患者的回顧性分析中,sunitib或sorafenil,加上CIK 細胞和樹突細胞治療,與輔助sorafeib或sunitib單藥治療相比,可以改善預後(中位 PFS分別為28 個月與11 個月)
最近一項針對 29 名對既往標靶治療無效的轉移性腎細胞癌患者的研究,將 CIK 細胞與抗 PD1 抗體藥物nivolumab 合併使用。治療有效反應率為 41%(腫瘤完全消失為24%;腫瘤部分消失為17%),中位疾病控制時間為 15 個月。毒性反應可控制。
截至目前,全球已有超過 700 名腎細胞癌患者接受了 CIK 細胞治療。整體而言,腎細胞癌患者接受 CIK 細胞治療似乎是安全的,最常見的副作用是輸注後的類流感症狀。研究設計和評估標準的異質性,以及每個研究治療的患者數量有限,阻礙了對 CIK 細胞抗腫瘤活性得出明確的結論,理想情況下,應在具有足夠效力的隨機試驗中進行評估,並使用當代藥物作為對照組。
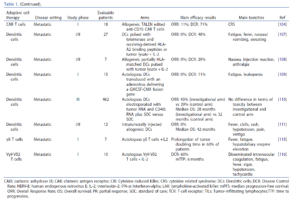
腫瘤浸潤型T細胞(TILs)
迄今為止,腎癌患者中 TILs 轉移的臨床試驗僅顯示出有限的成功。一項單中心研究評估了 55 例接受根治性腎切除術的轉移性腎細胞癌患者,接受 TIL 輸注合併低劑量 IL-2 治療的效果。在 48 例可以評估的患者中,5 例獲得 腫瘤完全消失(10%),14 例獲得 腫瘤部分消失為率為29%。緩解持久,中位整體存活時間為 22 個月,且未出現意外的副作用。
在此基礎上,啟動了一項多中心、隨機、的3期研究,比較接受 IL-2搭配 CD8+ TILs 治療,與接受 IL-2 聯合安慰劑治療的患者的預後。由於 TIL 組在緩解率和存活結果方面均未讓受試者獲益,研究在收錄了 160 例患者後提前終止。 TIL 生成的失敗率高(高達41%)且 TIL 表型差異大,可能對意向治療結果產生不利的影響,因此 TIL 療法是否對腎細胞癌患者有效仍未得到解答。過去十年,尚未進行繼性轉移 TIL 療法的研究。近期研究主要集中在利用最先進的技術優化腎細胞癌患者 TIL 的分離和擴增方案。因此,我們期待新一代設計合理的 TIL 過繼性轉移試驗的出現。
工程化TCR 的T 細胞
迄今為止,針對 TCR 工程化 的T 細胞治療腎細胞癌的臨床研究是有限。靶向人類內源性逆轉錄病毒 E (HERV-E) 衍生蛋白的細胞製劑也已開發出來,並在一項針對 11 例轉移性透明細胞腎細胞癌患者的首次人體一期劑量的遞增性研究中,對其安全性進行了測試。 3-4級治療相關不良事件包括:發燒性嗜中性白血球減少症及毛細血管滲漏綜合徵,中位無疾病惡化存活期(PFS)大約為2個月。針對滋養層糖蛋白(5T4,一種在腎細胞癌中過度表現的蛋白質)的TCR工程化T細胞,最近已顯示出針對腎細胞癌細胞的臨床前抗腫瘤活性。
CAR-T細胞
迄今為止,多種CAR-T細胞製劑已經在腎細胞癌患者的臨床試驗中進行研究。在一項開創性的第一期劑量遞增研究中,在12例轉移性腎細胞癌患者中測試了靶向碳酸酐酶IX(CAIX),一種在大多數的透明細胞之腎細胞癌中組成性表達的金屬酶的自體,第一代CAR-T細胞,
此CAR構建體在其胞外部分整合了鼠來源的G250 scFv,並且在CAR-T細胞治療前未進行淋巴細胞清除化療。未記錄到腫瘤的客觀緩解,但已證實產生人源抗CAR抗體。半數患者在最低劑量CAR-T細胞治療時出現2-4級肝酵素升高,肝臟切片結果顯示膽管上皮細胞表達CAIX,並有CAR-T細胞的浸潤。在抗CAIX CAR-T細胞輸注前給予G250 mAb可屏蔽CAIX位點,從而預防標靶/腫瘤外毒性。
已經開發出多種針對 CAIX 的替代 CAR T 細胞的構建體,從在細胞外結構域中整合人源化 G36 scFv 的第一代 CAR(G36-CD3ζ),到含有 CD28 和人源化 G36 scFv 的第二代 CAR(G36-AbCD28ζ)
近期已開發出第二代親和力/親和力精細調節的CAR-T細胞,以低親和力、高親和力的抗CAIX G9 scFv (G9-BBζ) 取代高親和力、高親和力的G36或G250 scFv],可望降低靶向/脫靶的毒性。
攜帶核心蛋白聚醣的溶瘤腺病毒與抗CAIX CAR-T細胞的結合已在小鼠模型中顯示出協同抗腫瘤作用,但迄今尚未在腎細胞癌患者中進行關於這種結合的臨床研究。為了限制CAIX標靶治療可能帶來的標靶/脫靶毒性,近期已開發出一種名為AB-2100的自體積體電路T (ICT) 細胞產品。 AB-2100 包含一個順序「與」邏輯閘,該邏輯閘門由靶向前列腺特異性膜抗原 (PSMA) 的啟動受體和靶向 CAIX 的 CAR 組成,CAIX 的表達受 PSMA 介導的啟動受體調控。 AB-2100 還包含一個合成路徑活化劑,可增強 STAT3 訊號傳導,從而增強 T 細胞的細胞殺毒性和擴增;以及一個 shRNA-miRNA 模組,目的在透過組成性敲低 FAS 和 TGFβR2 來增強對免疫抑制微環境的抵抗力。。
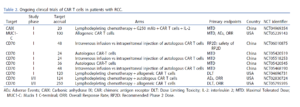
抗 CD70 CAR T 細胞的臨床研究正在快速進展。 CD70 是一種跨膜的糖蛋白,可與 CD27(腫瘤壞死因子受體)相結合,並在活化淋巴細胞、成熟樹突狀細胞以及包括腎細胞癌在內的多種實體癌症中有表達。一項第一期、首次人體、多中心、劑量遞增的 COBALT-RCC 試驗,在 16 例接受過大量治療的 CD70+ ccRCC 患者中測試了 CTX130。所有患者在 CAR-T 細胞輸注前均接受了淋巴球清除式的化療。總體而言,該治療顯示可控制的安全性,沒有劑量限制性毒性,嚴重不良事件僅在25%的患者中出現 1-2 級細胞激素釋放症候群 (CRS)。沒有報告免疫效應細胞相關神經毒性症候群 (ICANS)、移植物抗宿主疾病 (GvHD) 或噬血細胞性淋巴組織細胞增生症的病例。臨床受益率為 81%),12 名患者的病情穩定,1 名患者在 3 年的追蹤中達到持久性的腫瘤完全消失。中位的疾病控制時間為 2.9 個月。最近利用 Regnase-1 和 TGFβR2 的破壞來產生新一代抗 CD70 細胞產品 (CTX131),其臨床試驗即將開始。值得注意的是,TALEN技術用於敲除ALLO-316 CAR-T細胞中的TCRα恆定基因和CD52,以降低移植物抗宿主疾病(GvHD)的風險,並透過人源化抗CD52單株抗體選擇性耗竭宿主的T細胞。 ALLO-316 CAR-T細胞治療的臨床獲益率為71%。 9例患者腫瘤細胞表達CD70,其中臨床獲益率為100%。 18例患者中有11例(65%)出現CRS,其中1例為3級CRS。未報告ICANS或GvHD。雙標靶抗CD70/CAIX CAR-T細胞在CAR活化後分泌免疫檢查點抑制劑已被開發,其臨床試驗即將啟動。近期已開發出能夠針對低抗原密度腫瘤的抗CD70 HLA非依賴性TCR(HIT受體),似乎可以克服CAR-T細胞所遇到的抗原密度問題。
AXL和ROR2都是酪胺酸激酶受體,在包括腎細胞癌在內的多種癌症中過度表現。一項針對AXL或ROR2的CAR-T細胞的第一/二期雙臂臨床試驗正在招募復發/難治性轉移性RCC患者(NCT03393936)。針對乳頭狀腎細胞癌患者的c-met之可以靶向CAR-T的細胞(NCT03638206),或針對包括腎細胞癌在內的實體癌患者的細胞表面相關C末端抗原黏蛋白-1靶向CAR-T細胞(NCT05239143)的臨床試驗正在進行中。下表總結了正在進行的CAR-T細胞治療RCC患者的臨床試驗。目前,歐洲尚無CAR-T細胞臨床試驗正在招募腎細胞癌患者。
接種樹突細胞疫苗
很少有臨床試驗會評估樹突狀細胞疫苗在腎細胞癌患者的應用。一項早期之臨床試驗研究了負載端粒酶和Survivin衍生的HLA-A2結合肽的樹突細胞,在27例細胞激素難治性轉移性腎細胞癌患者中的應用。未觀察到嚴重的不良事件,27位患者中有13例之病況達到穩定狀態,且持續超過2個月。
在隨後的第一/二期研究中,7位進展性的轉移性腎細胞癌患者接受了用腫瘤裂解物衝擊的同種異體、部分HLA匹配的樹突狀細胞。在未觀察到任何客觀反應的情況下,未觀察到嚴重毒性。儘管如此,29%的患者記錄到腫瘤穩定,中位至病情惡化時間大約為6個月。在另一項第一期劑量遞增研究中,在 15 名轉移性腎細胞癌患者中測試了轉導了攜帶 GMCSF-CAIX 融合基因構建體的腺病毒的自體樹突狀細胞。未報告有嚴重不良事件。患者以 2:1 的比例隨機分配接受 Rocapuldencel-T 加標準治療或單獨接受標準治療。在研究組中未觀察到 療效改善的獲益。未報告嚴重不良事件。一項第一/第二期首例人體臨床試驗評估了12例中度或高度風險新診斷轉移性腎細胞癌患者,在計劃腎切除術前瘤內注射同種異體之樹突狀細胞的效果。儘管未觀察到客觀上的腫瘤緩解,但研究中的中位總生存期(42個月)超過了高風險腎細胞癌患者的歷史生存期,提示樹突狀細胞注射可能延長接受後續治療的患者的生存期。基於mRNA的個人化新抗原治療正日益受到關注。目前,一項針對已切除腎細胞癌患者的II期臨床試驗正在比較V940(一種基於個體化新抗原的疫苗)聯合pembrolizumab與安慰劑+pembrolizumab的輔助治療效果(NCT06307431)。
新興的細胞製劑
針對CAIX、CD70和EGFR的CAR-NK細胞已於近期開發。抗CAIX和抗EGFR 的CAR 或NK細胞均利用NK92細胞株(一種從淋巴瘤患者體內獲得的IL-2依賴性永生化的細胞株)作為CAR NK細胞的製備來源。雖然使用NK92細胞有利於轉導和擴增,但安全性考量(主要涉及輸注前需要放射治療以及較差的長期持久性)構成了其固有的缺點。一項針對臍血來源的CAR NK細胞的第一/二期臨床試驗目前正在招募晚期腎細胞癌、間皮瘤或骨肉瘤患者,該細胞靶向CD70,並在CAR結合後分泌IL-15 (NCT05703854)。
一項針對7例腎細胞癌患者的先導研究,目的在評估了過繼輸注γδ T細胞的安全性,結果顯示發燒、疲勞和肝膽酶升高是主要不良事件。一項針對 10 例轉移性腎細胞癌患者的研究發現,輸注自體 Vγ9 Vδ2 T 細胞可使 6 例患者病況獲得穩定。中位疾病進展時間約 6 個月。 CD3low Vγ9 Vδ1 T 細胞是為 20 例新鮮切除的腎細胞癌樣本中最豐富的 TIL 亞型,且其抗腫瘤活性已在體外得到證實。目前,過繼輸注由 TIL 獲得的臨床等級的 γδ T 細胞製劑似乎具有挑戰性。尚無臨床試驗在腎細胞癌患者中測試 CAR 巨噬細胞。儘管如此,腎細胞癌的免疫受到抑制的特徵,支持探索 CAR 巨噬細胞在這種惡性腫瘤中的作用。
過繼性細胞療法的毒性
過繼性細胞療法的毒性可以細分為三類:
- 繼發於淋巴球清除方案和IL-2激素的毒性;
- 免疫相關毒性;
- 細胞激素相關的富副作用。
與淋巴細胞清除相關的最常見不良事件包括:全血細胞減少和發熱性中性白血球減少。寒顫、發燒、低血壓、少尿和毛細血管滲漏症候群,都是接受IL-2治療的患者常見的毒性反應。標準介入措施通常足以控制與淋巴球清除方案和IL-2相關的不良事件]。免疫相關毒性包括交叉反應現象、標靶/非腫瘤毒性以及移植物抗宿主疾病 (GvHD)。
整體而言,此類不良事件的性質和嚴重程度,主要與標靶抗原在腫瘤和健康組織中的表現模式和密度有關。值得注意的是,已經有致命性的免疫相關毒性通報。例如:據報道,兩種不同的工程化TCR T 之細胞製劑定位在 MAGE-A3,由於交叉識別正常組織中未表達的其他 MAGE-A 家族成員,導致致命的脫靶神經毒性和心臟毒性。沿著這些思維,在系統性輸注第三代抗 HER2 CAR-T 細胞後,肺上皮細胞上的低密度 HER2 發生了致命的腫瘤外識別。
在同種異體過繼的細胞移植以及 TCR 工程化 的T 細胞治療後,均已記錄到急性和慢性 GvHD,在後一種情況下,同種異體反應性是由工程化的 α 和 β 鏈與其天然對應物之間的意外重組決定的。
免疫相關毒性的管理取決於所涉及的器官,主要依靠皮質類固醇和其他免疫抑制劑。安全開關可以提高過繼細胞製劑的安全性,而邏輯門控策略(與門和/或門)可以增強免疫識別的特異性,降低免疫相關不良事件的可能性。
細胞激素釋放症候群(CRS)、免疫效應細胞相關神經毒性症候群(ICANS)和免疫效應細胞相關噬血細胞淋巴組織細胞增生症樣症候群(IEC-HS),這些都是過繼性細胞免疫治療的主要細胞激素相關毒性。 CRS可表現為發燒、心搏過速、頭痛、缺氧、低血壓、血管擴張和毛細血管滲漏綜合徵,嚴重者可迅速發展為休克、呼吸功能不全和多重器官衰竭。 CRS患者通常會出現IL-6、IL-1和IFN-γ的全身性激增,且CRS嚴重程度與輸注T細胞的適應性、抗原親和力和腫瘤體積之間存在相關性。
ICANS 的臨床特徵是急性發作的注意力下降、頭痛、協調問題、語言障礙、意識模糊和譫妄。嚴重的病例可出現腦水腫、癲癇、昏迷甚至死亡。目前,ICANS 的發病機制尚不清楚。
IEC-HS 越來越被認為是過繼性細胞免疫治療的毒性,其臨床特徵是發燒、高鐵蛋白血症、肝脾腫大、伴有低纖維蛋白原血症的凝血病、血球減少和轉氨酶升高。這種高發炎症候群是由活化的 T 細胞(主要是由腫瘤抗原活化的 CAR-T 細胞)大量活化巨噬細胞所引起的,這反過來又促進了陽性 T 細胞/巨噬細胞環中 T 細胞的進一步活化。Tocilizumab(又名atlizumab/商品名雅美羅、Actemra),是一種 IL-6 R 結合型的單株抗體)和皮質類固醇,目前被認為是治療 CRS 的標準治療方案。雖然Tocilizumab似乎對 ICANS的 治療無效。
關於腎細胞癌的過繼性細胞治療研究目前尚處於起步階段,但正逐漸朝向發展前進。雖然目前過繼性細胞治療缺乏高水平的抗癌活性證據,但其可行性已得到證實,CIK細胞或抗CD70 CAR-T細胞的臨床試驗也記錄了初步的安全性和有效性跡象。 CIK細胞輔助治療與腎細胞癌患者的DFS結果改善有相關。
然而,在免疫檢查點抑制劑革命性的大時代,這種方法是否能產生任何效用仍有爭議。靶向CD70的CAR-T細胞最近顯示出具有臨床意義的益處,使疾病控制率超過80%,並在接受過大量治療的轉移性腎細胞癌患者中可能會誘導出首度持久性的腫瘤完全消失。雖然毫無疑問,這樣的成功代表了過繼性細胞療法和 RCC在腎癌治療上的一個里程碑,但大多數接受治療的患者的腫瘤控制持續時間似乎還遠遠不夠,中位控制時間僅為 2.9 個月。
從這些觀察中引出了幾個問題。在過繼性細胞療法的臨床試驗中,接受過大量治療的患者是否是理想的受試者,因為免疫系統的健康狀況在決定治療效果方面起著關鍵作用?屬於微觀之腫瘤病灶可能更容易浸潤時,過繼性細胞療法在術後輔助治療上是否會更有效?需要多少療程輸注過繼細胞才能獲得此類療法的抗腫瘤作用,輸注細胞數量(以及更有趣的細胞狀態,即分化狀態)與臨床結果之間是否存在任何關係?
全身性給藥是否本質上優於局部區域給藥的被動免疫療法?如果有的話,篩選出最有可能對過繼免疫治療產生反應的腎細胞癌患者的標準是什麼?這樣才能豐富臨床試驗,使其涵蓋合適的人群,並最大限度地提高成功率。
腎細胞癌是一種免疫原性癌症,其特徵是腫瘤抗原預測值高、免疫細胞浸潤廣泛以及局部免疫抑制強烈。儘管腎細胞癌的突變較為安靜,但仍存在高比例的插入/缺失和移碼之基因突變,導致新抗原的負荷高。廣泛的腫瘤內遺傳異質性不僅促進了腎細胞癌 克隆進化,也影響了克隆免疫原性的時空多樣性。
腎細胞癌表現出豐富的 CD8+ 和 CD4+ T 細胞、NK 細胞以及具有巨噬細胞特徵的髓系細胞、髓系抑制細胞 (MDSC) 和中性白血球的浸潤。矛盾的是,大量的 T 細胞浸潤卻與患者生存期較短有關,而高增殖率的 CD8+ T 細胞以及高比例的具有免疫活性的 T 細胞似乎更可以預測患者生存期延長。
毫不奇怪,浸潤性T細胞表現出衰竭表型,PD-1、TIM3、誘導型T細胞共刺激因子(ICO)和4-1BB的高表達。調節性T細胞、MDSC、巨噬細胞和嗜中性球所介導的抑制作用,以及腫瘤細胞上經典和非經典HLA抗原表現的改變,共同作用,形成免疫抑制的腫瘤微環境,最終促進免疫逃脫。
與上述免疫學特徵一致,免疫檢查點抑制劑在腎細胞癌患者中顯示出顯著的療效。然而,卻只有少數腎細胞癌患者能從免疫檢查點抑制劑中獲得持久性的腫瘤控制。過繼免疫細胞療法代表了一種進化的免疫療法,
未來十年腎細胞癌領域的研究將迎來TIL、CAR-T細胞、CAR-NK細胞以及抗腫瘤疫苗臨床試驗的大幅度增加。儘管以往的TIL試驗未能達到其療效終點,但當代淋巴細胞分離和擴增方案以及技術進步,使得開發面向新抗原的TIL培養物成為可能,這可能會推動該領域的研究工作。制定有利於TIL在惡劣微環境中存活和活性的臨床有效策略,被認為是未來成功的關鍵。
隨著CAR-T細胞在血液學領域的臨床應用,學術界和製藥業都在積極探索新途徑,探討這種治療方法對包括腎細胞癌在內的實體癌症是否有效。
仍有待解決的關鍵問題包括:
- 如何有效改善CAR-T細胞歸巢至腫瘤部位,
- 如何促進CAR-T細胞在腫瘤微環境中的存活,
- 如何確保CAR-T細胞的安全性,特別是避免標靶/脫靶的副作用。
CAR-NK 細胞製劑的現成性,使其治療形式格外引人注目,未來幾年將會有CAR-NK 細胞在腎細胞癌患者中療效和安全性的重要數據。最後,人們對癌症疫苗及其徹底改變癌症預防、治療或復發的潛力充滿期待。
腎細胞癌的特徵是廣泛的免疫浸潤、相對較高的腫瘤抗原預測值、強烈的局部免疫抑制,以及標靶藥物和免疫檢查點阻斷劑(單獨或聯合使用)近年來徹底改變了其治療方案。
過繼性細胞療法涵蓋了從 LAK 細胞和 CIK 細胞到 TIL、TCR 工程化 T 細胞、CAR-T 細胞、CAR-NK 細胞、CAR-巨噬細胞和樹突狀細胞等異質性的細胞製劑。大多數針對腎細胞癌患者的過繼性細胞療法臨床試驗都是在免疫檢查點抑制劑療法出現之前進行的,因此無法推斷過繼性細胞療法在當代臨床治療環境中的潛在效用。一些取得較大成功的領域包括腎臟切除術後之CIK細胞的輔助治療,以及對晚期患者進行抗CD70 CAR-T細胞的治療。
#細胞激素誘導殺手細胞
#Cytokine-induced killer cell
#CIK
#免疫細胞治療
#腎細胞癌
#腎癌
#Renal cell carcinoma
#RCC
#免疫檢查點抑制劑
#標靶治療
#手術治療
#術後輔助療法
#pembrolizumab
#CAR-T
#透明細胞
#癌症治療
#癌症熱治療
#癌症免疫細胞治療
#陳駿逸醫師
#衛福部台中醫院
#高禾醫院
#癌症中西醫整合
#外泌體陳駿逸醫師
#cik細胞治療優點
#癌症個人化益生菌
#個人化腸道益生菌NGS檢測
#台中市全方位癌症關懷協會
#阿克曼菌
#akkermansia muciniphila
陳駿逸醫師醫療門診服務時段
https://mycancerfree.com/contact/
更多陳駿逸醫師的癌症衛教影片請連接https://www.youtube.com/@mycancerfree
更多腫瘤治療相關資訊 請連接”陳駿逸醫師 與你癌歸於好” https://mycancerfree.com







