Encorafenib (商品名Braftovi,康奈非尼)是一种BRAF激酶抑制剂,先前核准可以用于治疗具有BRAF特定突变的不可切除或转移性黑色素瘤。Encorafenib抑制编码B-raf蛋白的BRAF基因,而B-RAF蛋白是一种参与各种基因突变的原癌基因。
2020年4月9日,美国FDA核准Encorafenib与Cetuximab(商品名Erbitux)的合并治疗用药方案,用于BRAF V600E突变阳性之转移性之结直肠癌成年患者的二线以后的治疗。该适应症是根据第3 期临床试验BEACON 的试验结果,收录665例BRAF V600E突变的转移性结直肠癌患者进行分组试验, 在 BEACON CRC临床试验中,encorafenib/cetuximab 治疗组的中位无疾病恶化生存期 (PFS) 为 4.3 个月,治疗的客观缓解率为 19.5%。
在随后的encorafenib搭配 binimetinib 用于第一线治疗 BRAF V600E 突变 之转移性结直肠癌患者的研究中 (ANCHOR CRC临床试验),encorafenib搭配 binimetinib的治疗方案则显示出更长的中位 PFS( 5.8 个月),治疗的客观缓解率为 48%.。
2023年胃肠道癌症研讨会(ASCO GI 2023)发表了最新的第3 期临床试验BREAKWATER(NCT04607421)的试验结果,将化疗方案 mFOLFOX6 或 FOLFIRI与encorafenib /cetuximab的组合治疗方案中,于 BRAF V600E 突变之转移性结直肠癌患者中观察到优质的抗肿瘤活性和安全性。
BREAKWATER(NCT04607421)的试验设计
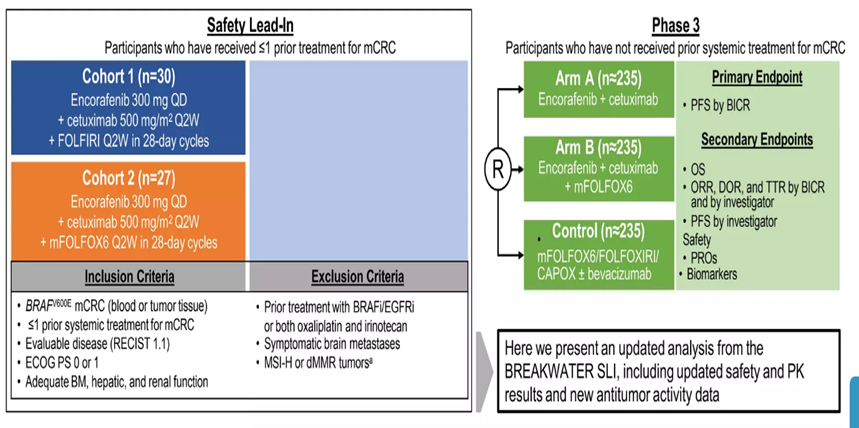
安全先导的探索研究,目的在评估Encorafenib /cetuximab抗加化疗的毒性,然后再进行第3 期的研究。 安全导入试验中收录了 57 名患者, 所有患者均具备有 BRAF V600E 突变型之转移性结直肠癌,既往都接受过全身治疗,疾病皆为可评估的,体能状态、骨髓、肝和肾功能良好。 患者既往都未曾接受过 BRAF 或 EGFR 抑制剂的治疗,也未接受过oxaliplatin或irinotecan的化学治疗。 有症状的脑转移患者、或式微卫星高度不稳定性(MSI-H)或肿瘤错配修复缺陷(dMMR)的患者被排除在该研究之外。
有30位患者在Cohort 1: 28 天的疗程中接受每天一次 encorafenib 300 mg与每 2 周一次的FOLFIRI化疗方案的组合。
27 名患者在Cohort 2 : 28 天的疗程中接受每天一次 encorafenib 300 mg与每 2 周一次的FOLFOX化疗方案的组合。
安全导入分析的主要研究终点是由剂量限制性的毒性 (简称DLT)所确定的安全性。 作为关键的次要终点,透过发生不良事件 (AE)、剂量中断、剂量调整和治疗中断的患者百分比进行评估安全性。
于安全先导的探索研究中,分别评估一线和二线治疗患者的疗效结果。
在第一线就接受encorafenib/cetuximab 和 mFOLFOX6 治疗的19名患者中,治疗的客观缓解率为 68.4%。 在该组达到肿瘤缓解的 68.4% 患者中,有5.3% 是肿瘤完全缓解,63.2%是肿瘤部分缓解,21.1%是肿瘤疾病稳定(SD),5.3%是肿瘤疾病进展。而中位的 PFS 为 11.1 个月。
在第一线就接受encorafenib/cetuximab 和 mFOLFIRI治疗的12名患者中,治疗的客观缓解率为75%。 在该组达到肿瘤缓解患者中,有16.7% 是肿瘤完全缓解,53.3%是肿瘤部分缓解,16.7%是肿瘤疾病稳定(SD),没有人出现肿瘤疾病进展。而中位的 PFS 为 11.1 个月尚未达到可以分析的阶段。
在第二线才接受encorafenib/cetuximab 和 mFOLFOX6 治疗的8名患者中,治疗的客观缓解率为 37.5%。 在该组达到肿瘤缓解患者中,肿瘤完全缓解是0%,37.5%是肿瘤部分缓解,62.5%是肿瘤疾病稳定(SD),无人出现肿瘤疾病进展。而中位的 PFS 为 10.8 个月。
在第二线才接受encorafenib/cetuximab 和 FOLFIRI治疗的18名患者中,治疗的客观缓解率为 44.4%。 在该组达到肿瘤缓解患者中,肿瘤完全缓解是5.6%,38.9%是肿瘤部分缓解,38.9%是肿瘤疾病稳定(SD),无人出现肿瘤疾病进展。而中位的 PFS 为 12.6 个月。
值得一提的是“BEACON CRC临床试验中的另一个探索性终点,就是在给药后第 6 周进行了BRAF V600E 清除率的评估,使用了液态循环肿瘤DNA(ctDNA)的基因检测分析。
患者在治疗前和治疗 6 周后都有配对的血液检查样本。75% 的患者在给药后第 6 周的那个时间点,都发现他们的 BRAF V600E 变体清除掉了,反映了该encorafenib/cetuximab与化疗的组合方案的活性。且无论是一线和二线治疗上都存在这个现象。
治疗期间的液态循环肿瘤DNA(ctDNA)的基因检测分析分析表明,大多数患者在给药 6 周后BRAF V600E 基因的变体都清除了。研究者更说明了 “当将这些结果与一线或二线化疗的历史结果进行比较时,ctDNA 的早期清除证实了这种治疗组合显示出高度的抗癌活性。”
在第一线就接受encorafenib/cetuximab 和 FOLFIRI治疗的患者中,给药 6 周后BRAF V600E 基因的变体的清除率为 57.1% ,而对照之下,接受二线使用encorafenib/cetuximab 和 FOLFIRI治疗的患者则为 60.0%。
在第一线就接受encorafenib/cetuximab 和 FOLFOX治疗的患者中,给药 6 周后BRAF V600E 基因的变体的清除率为 100% ,而对照之下,接受二线使用encorafenib/cetuximab 和 FOLFIRI治疗的患者则为 85.7%。
在安全导入的研究期间,只有 1 名患者出现剂量限制性的毒性,为第 4 级中性白血球减少症,该患者之毒性在第 7 天后得到妥善解决。总体而言,两个组的所有患者均发生了治疗副作用。 48.1% 的encorafenib/cetuximab 和 mFOLFOX6 治疗组中观察到严重的治疗副作用,而接受encorafenib/cetuximab 和 FOLFIRI治疗治疗的患者有 33.3%。
在encorafenib/cetuximab 和 mFOLFOX6 治疗组中,77.8% 的患者发生严重等级的治疗副作用,而在encorafenib/cetuximab 和FOLFIRI 治疗组中,这一比例为 50.0%,治疗副作用导致剂量减少的比例分别为 63.0% 和 40.0%。 治疗副作用导致永久停药的比例分别是 18.5% 和 20%。
两组中的大多数副作用都与研究中使用的药物有关。 与任何药物相关的严重 副作用发生在接受encorafenib/cetuximab 和 mFOLFOX6 治疗组有 25.9%,而在encorafenib/cetuximab 和FOLFIRI 治疗组为 13.3%。 两组均未出现因 治疗副作用导致的死亡。
在两个治疗组中观察到的最常见的任何级别治疗副作用是恶心 (比例为74.1%)、发烧 (比例为48.1%)、呕吐 (比例为40.7%) 和腹泻 (比例为33.3%)。
“ctDNA 的早期清除证实了这一活动。 当我们将这些结果与一线或二线化疗的历史结果进行比较时,我们感到鼓舞的是,这种组合显示出高度的活性,”Kopetz 说。 在他的演讲中。
#Encorafenib #Cetuximab #Braftovi #康奈非尼 #binimetinib
#BRAF V600E #结直肠癌 #BEACON #ANCHOR #BREAKWATER
#NCT04607421 #基因检测 #Guardant Health 360
#液态循环肿瘤DNA #ctDNA #BRAF清除
#胃肠道癌症研讨会 #ASCO GI 2023
更多陈骏逸医师的癌症卫教影片请连接 https://mycancerfree.com/cn/videos-cn/
更多肿瘤治疗相关信息请连接陈骏逸医师 与你癌归于好https://mycancerfree.com/cn/home-cn/#
更多癌症病友需知 请连接“全方位癌症关怀协会” https://www.cancerinfotw.org/index.php
欢迎参与脸书社团:陈骏逸医师的用心话聊俱乐部 www.facebook.com/groups/456281992960876/

