血液肿瘤科 陈骏逸医师
当将局部肿瘤加热至39-45℃范围内的温度,可以阻止癌细胞的增殖并杀死癌细胞,其对癌细胞之影响的程度取决于加热的温度和暴露在该温度下的时间的组合,它们一起被称之为热剂量。当癌细胞暴露在高温时,会发生一些变化。虽然加热会改变癌细胞膜的特性,导致细胞形态、细胞内钠和钙水平以及膜电位的改变。令人惊讶的是,这些现象都与癌细胞的死亡率没有很好的相关性,因此似乎不是热诱导细胞毒杀性的直接机制。
除了细胞膜外,癌细胞内的二级结构蛋白质被认为是对热最敏感的生物分子,蛋白质的变性可能会介导轻度高温所带来的许多影响。尽管DNA本身在39-45°C的温度下并不会损坏,但由于此时合成酶和聚合酶会变性和聚集,DNA的自身合成和聚合尤其对热更加敏感,这被认为对细胞的健康会有很大的影响。而负责其他重要细胞活动(例如 DNA 修复)的蛋白质功能受损,也可能与此有关。
一般来说,在足够的热剂量给予后,癌细胞会透过坏死(细胞迅速失去膜的完整性)或凋亡(触发程序性的细胞死亡),而每种死亡都有不同的免疫调节活性。
最初,局部温热治疗的目的只是烧掉癌细胞,将肿瘤清除,类似于手术。由于过去已知热剂量与细胞毒杀性之间存在着正相关性,因此人们认为加热温度越高,抗癌效应会越好。然而,在过去的20年里,越来越多的证据表明,加热肿瘤至39-45°C的温度范围,可以带来意想不到的好处,提高抗肿瘤的免疫力,在上述的范围内,不同温度下会发生不同的免疫活化机制(如下图 )。
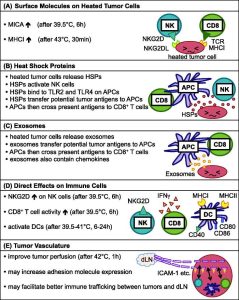
局部肿瘤的温热治疗会诱导的不同免疫活化机制。
- 加热癌细胞会增加了 MICA(一种NKG2D 配体)和第一类 MHC 的表面表达,会因此使得癌细胞分别对 NK(自然杀手)细胞和 CD8+ T 细胞的裂解作用,更加敏感。
(B) 加热过的癌细胞会释放 HSP(热休克蛋白),进而活化 NK 细胞和 APC(抗原呈递细胞)。 HSP 含有潜在的肿瘤抗原,当APC 吸收了HSP-抗原复合物,会将其内的肿瘤抗原交叉呈现给 CD8+ T 细胞。
(C) 被加热的癌细胞会释放出外泌体。外泌体含有潜在的肿瘤抗原,当APC 吸收了肿瘤抗原,并将抗原交叉呈现给 CD8+ T 细胞。
(D) 肿瘤中的免疫细胞,例如 NK 细胞、CD8+ T 细胞和树突细胞(DC),也会因为被加热而并被活化。
(E)加热后,肿瘤内的血管系统会变得更具渗透性,且其上之黏附分子表现可能增加,这将会有利于免疫细胞在肿瘤和周遭引流的淋巴结之间的运输效率提升。
加热癌细胞后 其表面分子会有所变化
热治疗可以增加癌细胞对免疫系统的可辨识度。
在体外将癌细胞在39.5°C 下加热6 小时候,会增加MICA(一种NKG2D 配体)在肿瘤细胞的表面表达,但不会增加第一类 MHC 的表面表达,从而使癌细胞对自然杀手(NK) 细胞的裂解作用更为敏感。在体外 43°C 下加热 30 分钟,癌细胞表面上之第一类 MHC 的表面表达水平才会有所增加,这会使得 CD8+的 T 细胞能够更好地去识别癌细胞。
加热肿瘤内的 NK 细胞和 CD8+ T 细胞,会让它们对癌瘤细胞的溶解能力更为增加,创造出更具发炎性的细胞激素之肿瘤微环境,如此可以进一步改善抗肿瘤的免疫反应。
热治疗诱导的抗肿瘤免疫方面,最广泛被研究的主题是热休克蛋白(HSP)的作用。 HSP 是一组异质的分子伴侣,具有各种功能,当细胞受到各种压力(包括热暴露)时,HSP的功能会上调。
HSP 通常根据分子大小,可以分为亚组;小HSP(<40 kDa)、Hsp40、Hsp60、Hsp70、Hsp90和Hsp100-110,其中Hsp70被认为最具有免疫刺激的作用。 Hsp70 具有可被 NK 细胞辨识,并刺激 NK 细胞的增殖和表现出溶解细胞活性的抗原决定基。 Hsp70 也会由受到热压力的癌细胞所释放,并直接与树突细胞等抗原呈现细胞 (APC) 上的 TLR2 和 TLR4 相结合,以活化 APC 产生细胞激素和肿瘤抗原的摄取。
由于 HSP 是分子伴侣,释放到细胞外环境中的 HSP 通常会与癌细胞内的蛋白质结合,因此当树突细胞等抗原呈现细胞吞噬癌细胞后,HSP 可以将其所含有之潜在的肿瘤抗原转移到抗原呈现细胞。然后这些抗原呈现细胞能够将肿瘤抗原交叉呈现给 CD8+ 的T 细胞,从而引发肿瘤特异性 CD8+ 的T 细胞之免疫反应,进而推迟肿瘤的生长。 HSP 会因为加热或其他压力而增加,但这种反应需要一定的时间才能形成,温和的逐步加温会比起快速达到高热,更具有刺激这种的机制,较温和的加热会产生受损且难以生存的癌细胞,从而增加 HSP 的表达,从而增加透过上述途径的肿瘤抗原交叉地呈现给抗原呈现细胞。
虽然许多HSP被认为具有免疫刺激的作用,因此有助于抑制肿瘤的生长,但也有报告指出某些HSP 在抑制肿瘤生长方面上是具有负面作用。例如,Hsp90 透过直接与肿瘤抑制蛋白 p53 的相互作用,进而抑制p53,而去抑制癌细胞凋亡。虽然 Hsp110-肿瘤抗原复合物可以刺激树突细胞而产生发炎细胞激素和启动抗原特异性的幼稚 T 细胞,但 Hsp110 与树突细胞上所表达的清道夫受体 A 的结合,反而会降低树突细胞的肿瘤抗原交叉呈现之活性。
由于热休克蛋白不仅是危险讯号,也是细胞的救生员,保护细胞免于受到环境的压力,因此,有一些热休克蛋白会刺激免疫系统去攻击受加热的肿瘤细胞,而另一些热休克蛋白则会阻止受热之癌细胞的死亡,也就不足为奇了。因此,在应用局部温热治疗癌症时,应该要注意的是,整体结果受到不同热休克蛋白所有效应之总和的影响,取决于 HSP 亚群、加热温度和癌细胞的类型。例如,对于 B16F10 小鼠黑色素瘤细胞株中0,Hsp70 的释放在 41°C 时开始,在 43°C 时达到最大值,并在 45°C 时完全会减少。至于加热长度,30 分钟的加热会比起 60 或 120 分钟,更能诱导 Hsp70。这些参数对于引发HSP 的最大免疫活化是非常关键的,特别是当某些 HSP 的功能优于其他 HSP 时。这种温度敏感性凸显了需要了解相对较窄的热剂量范围内的温度影响,并且能够准确控制热剂量,将其均匀地加热于肿瘤。
除了热之外,许多种生理和化学压力也会诱导HSP的表现。最近癌症治疗研究中最引人注目的发现之一就是杀死癌细胞的化疗药物的功效,实际上是依赖于化疗引起的免疫原性的细胞压力和死亡所引起的免疫活化作用。事实上,当这些化疗药物治疗肿瘤细胞后会释放出 HSP,进而会活化树突细胞和 T 细胞。因此,如果局部肿瘤热治疗也能够透过诱导热休克蛋白,去刺激抗肿瘤的免疫反应,而发挥与免疫疗法异曲同工的作用,也就不足为奇了。
此外,虽然局部肿瘤温热治疗诱导的HSP在很大程度上是有肿瘤特异性的,但仅出现在局部加热的肿瘤中,像是全身施用化疗药物所诱导的HSP则是非特异性的,但也发生在任何位置的肿瘤中。证明了当局部肿瘤给予温热治疗与某些全身性化疗药物做组合,会在刺激全身性抗肿瘤的免疫反应方面上,发挥协同的抗癌作用,这点与免疫疗法和化疗的搭配通常可以获得协同效益,有相似之处。
外泌体(exosome)是直径 30-100 nm 的小膜囊泡,通常由细胞所释放,在细胞间的通讯中发挥作用。癌细胞衍生的外泌体含有丰富的肿瘤抗原,因此现在被认为是极有潜力的免疫刺激因子。
用肿瘤来源的外泌体去脉冲树突细胞,会导致肿瘤抗原转移到树突细胞,而这些树突细胞会刺激免疫系统中的肿瘤抗原特异性的CD8+ T 细胞之免疫反应。
经历压力(例如缺氧和高温)的癌细胞会释放出更多的外泌体。加热癌细胞后所释出的外泌体,确实可以增强与刺激抗肿瘤免疫反应的能力。各种人类癌细胞中在42-43°C加热1小时后,所收集到的外泌体确实携带了肿瘤抗原,并作为树突细胞的肿瘤抗原之来源,诱导树突细胞的成熟活化和肿瘤特异性CD8+ T细胞的反应。这些外泌体中含有 CCL2、CCL3、CCL4、CCL5 和 CCL20 等趋化因子,有助于吸引树突细胞以及 CD4+ 和 CD8+ 的T 细胞。
另一方面,肿瘤来源的外泌体富有免疫抑制的特性也是已知的。例如,一些肿瘤来源的外泌体,会表达FasL和TRAIL等死亡配体,可以诱发活化T细胞的凋亡。外泌体也可以含有 NKG2D 配体,并透过阻断 NKG2D 的受体去抑制 NK 细胞和 CD8+ T 细胞的 NKG2D 依赖性的细胞毒杀性。还有一些外泌体透过 TGF-β 依赖性的机制,去诱导骨髓源性抑制细胞(MDSC)和调节性 T 细胞(Treg)的分化。尽管在热刺激的情况下,肿瘤来源之外泌体在免疫刺激中的这些负面作用尚未被报保,但局部加热肿瘤所诱导的外泌体,总体上是否会刺激或是抑制抗肿瘤免疫反应的问题,需要再仔细评估,然而走向如何可能要取决于特定肿瘤的细节、热剂量和治疗前现有的免疫反应。
当用局部肿瘤温热治疗癌症时,于肿瘤内浸润的免疫细胞也会暴露在热之下。而发烧是一种与抵抗感染相关的自然免疫刺激机制,因此达到发烧水平的高热对白血球具有刺激作用,也就不足为奇了。体外研究发现,将人类自然杀手细胞在39.5℃ 下加热6 小时,不会改变NKG2D 的表面表达水平,但会导致NKG2D的聚集,如同用IL-2 激活的自然杀手细胞上所看见,从而产生更好的细胞裂解的活性。将抗原特异性 CD8+ T 细胞在 39.5℃ 下加热了 6 小时,可以增强抗原特异性的 IFN-γ产生,和强化靶向肿瘤细胞的免疫杀伤能力。
在 39.5–41°C 加热6–24 小时可以活化树突细胞,第一与第二型MHC、CD40 以及共刺激标记物 CD80 和 CD86 ,都会因此上调,以及更好地诱导抗原特异性T 细胞的增殖。也有人报告了在 39.5–40°C 体外培养 2–3 小时后,会活化巨噬细胞。
几乎所有相关研究文献都同意,透过直接加热来活化免疫细胞,仅在达到发烧范围的温度下观察到,而在41°C以上的较高温度下则观察不到这现象,这强调了选择适当加热的温度的重要性。
最后,肿瘤内血管系统的变化可能也有助于免疫细胞的动员。局部肿瘤温热治疗增加肿瘤的血管系统之通透性。肿瘤在 42°C 下加热 1 小时,进入肿瘤的小动脉直径会增加了 35%,导致更好的肿瘤内的血流灌注。总体而言,局部肿瘤温热治疗在40–43°° 的范围内,肿瘤中的血流会得到改善,并且在温度高于 43°C 时,由于出血的原因导致此一效果会消失。由于更好的血流灌注有可能促进肿瘤和周边引流淋巴结之间,包括树突和 T 细胞在内的免疫细胞,其运输效率会的增加,因此加热至 40-43°C 的温度可能会因此进一步增加免疫治疗的好处。
透过血管系统之黏附分子的变化可以进一步改善免疫细胞的运输。进行 39.5°C 持续 5 小时的全身热治疗,会增加肿瘤内 IL-6 反式讯号的传导,如此会增加了肿瘤血管系统上的 ICAM-1 的表达,以及肿瘤特异性 CD8+ 效应/记忆 T 细胞朝向肿瘤的运输。在 43°C 下局部加热肿瘤 30 分钟会增加肿瘤内 IL-6 的浓度。因此,这种局部肿瘤热治疗可能也会增加肿瘤血管系统上的 ICAM-1,并增强 T 细胞或其他免疫细胞进入肿瘤的运输效率。
#HSP
#热休克蛋白
#外泌体
#Exosome
#自然杀手细胞
#树突细胞
#癌症热治疗
#免疫治疗
#热活化免疫力
#肿瘤电热疗
#PD-L1
#免疫检查点抑制剂
#免疫细胞治疗
#癌症免疫疗法
#肿瘤温热治疗
#细胞疗法陈骏逸医师
#肿瘤温热治疗陈骏逸医师
#癌症细胞治疗
#高禾医院陈骏逸医师
#卫福部台中医院
#癌症中西医整合陈骏逸医师
#癌症中西医整合治疗
#cik细胞治疗优点
#自动化微流体生物芯片
#癌症个人化益生菌
#台中市全方位癌症关怀协会
更多陈骏逸医师的癌症卫教影片请连接https://www.youtube.com/@mycancerfree
更多肿瘤治疗相关信息 请连接“陈骏逸医师 与你癌归于好” https://mycancerfree.com
更多癌症病友需知 请连接“全方位癌症关怀协会” https://www.cancerinfotw.org/index.php
欢迎参与脸书社团:陈骏逸医师的用心话聊俱乐部 www.facebook.com/groups/456281992960876/

