对于越来越多的免疫力低下患者,特别是癌友而言,感染的预防是至关重要的。这些免疫力低下患者一旦感染后,通常会有更高的发病率和死亡率,并且抗感染治疗的成效通常不如免疫力未受损的健康者。尽管疫苗接种似乎是预防感染的有效方法,但许多免疫力受损的患者无法在接种疫苗后,身体能主动产生保护性免疫反应。此外,癌友接种活病毒疫苗,可能导致活病毒在体内不受控制地增殖,反倒受其危害。
是否会感染的风险以及是否可以通过疫苗接种来有效预防感染,很大一部份直接取决于癌症患者的“免疫力受到抑制的状态是如何的严重”或是”癌症疾病的严重程度”。免疫抑制程度越厉害,患者对疫苗接种产生保护力的反应之可能性就越小。尽管某些现有的疫苗可以为免疫功能低下的患者提供了部分好处,但不能认定该类疫苗在免疫功能低下的患者一定会产生反应。
要想成功保护免疫功能低下的成年人,可能需要使用疫苗注射产生主动免疫,或是借助施打免疫球蛋白提供被动免疫,以及一些类似戴口罩等的辅助防护措施,或是A型流感爆发期间预防性的使用抗病毒药物。
接下来我会对血液系统恶性肿瘤和实体癌(例如:肺癌、乳癌、大肠癌、肝癌等)ㄖ接受化疗治疗的患者,或是其他免疫功能低下的癌友为何建议疫苗接种的基本知识逐一讨论。至于接受造血干细胞移植或实体器官移植,或是感染 HIV 的患者,以及健康的儿童和成人之接种疫苗相关问题则不予讨论。
基本的观念澄清
成年人罹患严重感染的风险会因为罹患癌症后而有所增加,尽管风险程度会因为潜在的癌症疾病和所用会造成免疫抑制的抗癌治疗类型而有所差异。而目前有许多这些感染是可以透过接种疫苗预防的,这点大家因为新冠肆虐下,是很清楚的。
血液系统恶性肿瘤的患者其实是要比实体瘤患者的免疫功能低下。然而,实体癌的患者当然也有受感染的风险,究其原因不外是身体虚弱、营养不良等等,在某些情况下,还有因为肿瘤造成身体解剖学构造的破坏,例如,肺癌阻塞支气管的引流,造成肺癌病患易感染肺炎。
所以接种疫苗预防感染这档子事对癌症患者是很重要的,但非常理想情况下不要在化疗或免疫治疗会让免疫受到抑制的期间去接种疫苗,因为在这种时候,疫苗虽然有施打但可能无效,或是因为接种活性疫苗可能会导衍生感染。但现实是大多癌症患者需要积极地治疗,在抗癌治疗期如何选择疫苗的接种时间将在下文做详尽的讨论。
近年来,许多癌症的治疗已大为进步,从而改善了患者的预后。美国传染病学会 (IDSA) 制定了针对美国免疫功能低下患者的免疫接种建议 。美国免疫实践咨询委员会 (ACIP) 还在其指南中纳入了针对免疫功能低下患者的疫苗接种建议。以下是美国对于各种医疗状况及疾病,建议接种疫苗的时机:
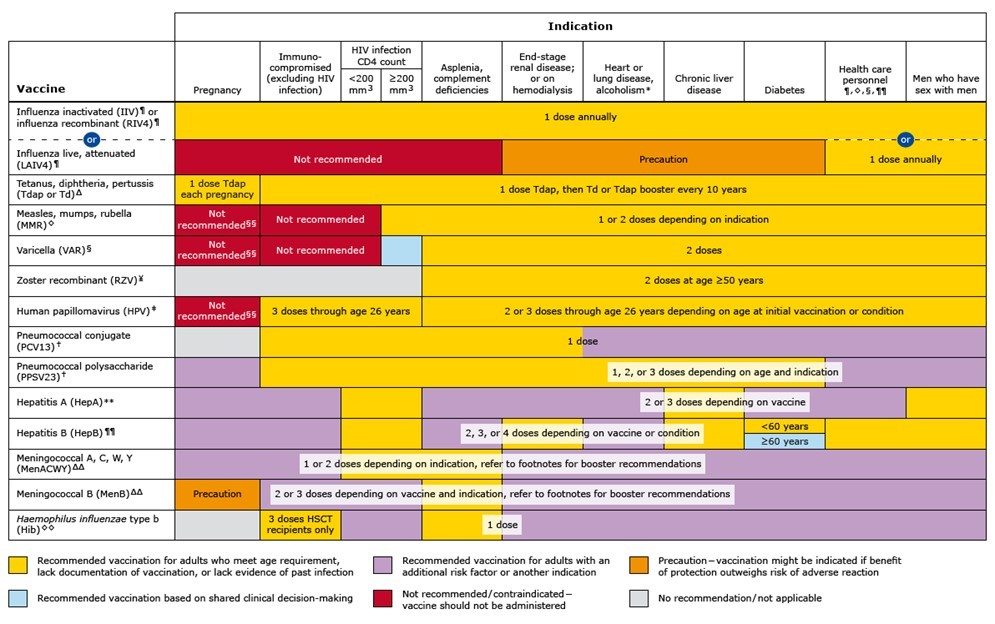
首先当既定要接种的疫苗有灭活制剂和活性制剂都可以使用时,癌症患者应该首选灭活疫苗。
接下来,我将癌症患者接种疫苗的建议时间点总结如下:
癌症患者疫苗的建议接种时间点
- 化疗前接种疫苗– 建议成年癌症患者应该在化疗开始前、其他免疫抑制药物的治疗前、放射治疗或脾脏切除手术前,接种所有符合适应症的疫苗。符合适应症的灭活疫苗应在化疗前至少2 周前给予,而符合适应症的的活性病毒疫苗应在化疗前至少4 周前接种。
- 化疗期间应该要避免接种活应ㄒ疫苗——正在接受化疗或其他免疫抑制治疗期间的癌症患者,不应该接种活性病毒疫苗,因为会有疫苗衍生的感染风险。
- 化疗期间的灭活性疫苗的接种– 正在接受化疗或其他免疫抑制治疗期间的癌友,一般建议应该避免接种灭活疫苗,因为它们可能会无效。但是,鉴于需要每年注射一次预防流行性的流感疫苗,目前倾向于对癌友建议每年应该要注射流感疫苗。
如果在化疗期间接种其他灭活疫苗,除非有保护性抗体的产生已经被证明,否则它们不应被建议接种。对于此类患者,应该在免疫能力恢复后重新后才去接种疫苗。如果先前的疫苗接种发生在化疗之前,除了接受造血干细胞移植受者外,通常不需要在化疗或放疗结束后对个体再进行接种。
- 化疗完成后进行疫苗的接种——白血病、淋巴瘤或其他恶性肿瘤患者,当其疾病处于缓解期,且未接受抗 B 细胞抗体(如rituximab, alemtuzumab),且化疗已经完成了至少间隔 3 个月以上,则建议根据特定年龄情况,可以接种灭活疫苗以及活性病毒疫苗,例如水痘疫苗;麻疹、腮腺炎、风疹;麻疹、腮腺炎、风疹和水痘;和带状疱疹。对于已接受抗 B 细胞抗体的患者,灭活疫苗和活性疫苗的接种,至少应推迟至少六个月。
关于癌友可能需要接种的灭活(不活化)疫苗,我们再来复习一下:
l 破伤风类毒素、白喉类毒素和百日咳疫苗
许多接受化疗的肿瘤患者无法有效的预防破伤风、白喉和百日咳。在一份研究报告提及只有 59% 的急性白血病患者,有做到预防破伤风。尽管在一项研究中,接受维持性化疗的儿童其疫苗接种后的免疫反应与在健康儿童中观察到的相似,但对癌症患者接种对破伤风和白喉疫苗后的免疫反应知之甚少。
但是还是应该建议对所有癌症患者进行破伤风和白喉疫苗的接种好加强免疫。此外,未接种过无细胞之百日咳疫苗的成年人应该接种含有破伤风类毒素、减量白喉类毒素和无细胞百日咳 (Tdap) 的疫苗。破伤风和白喉类毒素 (Td) 或 Tdap 最好在开始抗癌治疗前就建议接种,最好不要在强化化疗期间内给药。
l 小儿麻痹疫苗
灭活的小儿麻痹疫苗是唯一被推荐可以用于免疫缺陷个体及其家庭接触者。然而,在免疫力有缺陷的患者,接种此疫苗后不能保证一定有保护性免疫反应。
l 肺炎链球菌疫苗
癌症患者应在开始抗癌治疗前接种肺炎链球菌疫苗,但是应该避免在化疗期期内接种肺炎链球菌疫苗,因为可能会出现不良反应。
免疫功能低下患者接种肺炎球菌疫苗适应症的条件是:
- 1.先天性或后天性免疫缺陷(包括 B 或 T 淋巴细胞缺乏、补体缺乏和吞噬功能障碍,不包括慢性肉芽肿病)
- 2.艾滋病
- 3.血液系统恶性肿瘤(如白血病、霍奇金氏淋巴瘤、非霍奇金淋巴瘤、多发性骨髓瘤)
- 4.接受实体器官移植
- 5.医源性免疫抑制(包括长期全身性糖皮质激素或放射治疗)
- 6.慢性肾病
- 7.肾病症候群
- 8.
不建议肺炎球菌疫苗用于接受造血干细胞移植、解剖或功能性无脾的患者,或在没有免疫功能低下的情况下植入人工耳蜗或脑脊液漏的患者。
23 价肺炎链球菌疫苗(PPSV23; Pneumovax)在美国已经多年来都被建议可以用于免疫功能低下的成年人,但 2012 年开始,美国免疫实践咨询委员会 (ACIP) 也开始建议 13 价肺炎链球菌疫苗(PCV13;Prevnar 13) 也可以用于19 岁或以上罹患有某些高危险疾病,包括癌症的个体,而美国传染病学会 (IDSA) 也支持针对免疫功能低下者这种肺炎疫苗的接种建议。
所以根据 ACIP 和 IDSA,我们建议成年癌症患者接种肺炎链球菌疫苗,除了PPSV23 23 价外,还可以接受 PCV13 13价:
以下是美国对于免疫功能低下的任何年龄成人接种肺炎球菌疫苗的最新建议:
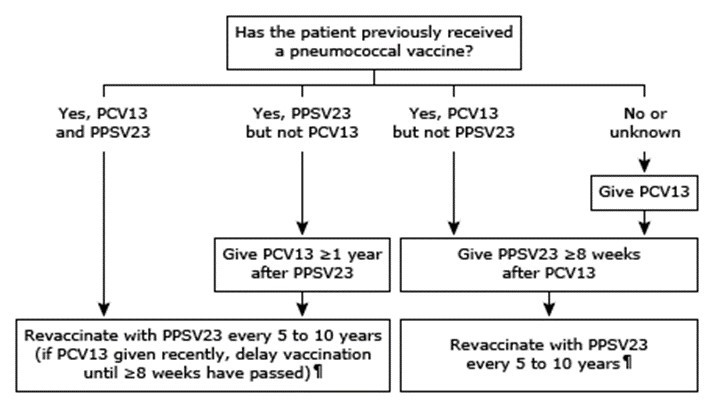
PCV13:13价肺炎链球菌疫苗; PPSV23:23价肺炎链球菌疫苗。
² 对于之前未接种过 PCV13 或 PPSV23 的患者,应该先接种一剂 13价肺炎球菌结合疫苗,然后至少在八周后再接种一剂23价肺炎链球菌疫苗。
² 对于以前接受过一剂或多剂的23价肺炎链球菌疫苗的患者,应该在接受最后一剂的23价肺炎链球菌疫苗后一年或多年,再行接种单剂的13价肺炎链球菌疫苗。
² 对于需要额外追加23价肺炎链球菌疫苗剂量的患者,应在13价肺炎链球菌疫苗后至少 8 周,以及最近一次 23价肺炎链球菌疫苗接种后至少五年后,再行给予第一次追加的23价肺炎链球菌疫苗。
肺炎链球菌感染是肿瘤患者发病和死亡的重要原因。他们对23价肺炎链球菌疫苗接种后的反应虽然各不相同,但如果在抗癌治疗开始前接种23价肺炎链球菌疫苗疫苗,成效会更好,甚至接近健康者的反应,而血清 IgG-2 浓度可以预测对疫苗的反应能力。
化疗后会让23价肺炎链球菌疫苗的保护效应大大减弱,尤其是白血病和头颈癌患者开始癌症治疗后,才接种23价肺炎链球菌疫苗的疫苗保护力反应特别差。而霍奇金氏淋巴瘤患者中,23价肺炎链球菌疫苗的保护力反应在治疗后长达 7 年之内仍然是受到损害的。至少在霍奇金氏淋巴瘤中,使用七价肺炎链球菌结合疫苗(PCV7;Prevnar 7)进行初免,似乎可以改善对随后接种23价肺炎链球菌疫苗的保护力反应。
l 感冒嗜血杆菌疫苗
除非是接受造血干细胞移植的癌友,否则成年癌症患者发生B型流感嗜血杆菌感染的风险不高。因此,除非有接受造血干细胞的移植,否则通常不建议对成年癌症患者接种感冒嗜血杆菌疫苗。
l 脑膜炎球菌疫苗
针对脑膜炎球菌感染风险较高的个体,建议接种脑膜炎球菌疫苗,例如 11 至 18 岁的儿童和某些其他群体,例如住在宿舍的大学新生、前往脑膜炎奈瑟菌高流行地区、患者伴有终末补体成分缺陷、解剖或功能性无脾脏等。
目前没有针对癌症患者是否应该接种脑膜炎球菌疫苗的具体建议,但任何有脑膜炎球菌疫苗接种其他适应症的成年癌症患者,则都应该接种脑膜炎球菌疫苗。癌症患者接种脑膜炎球菌疫苗的疫苗保护力反应可能不是最理想的
l 流感疫苗
癌症成人建议应该每年接种一次流感灭活疫苗,唯一的例外就是正在接受抗 B 细胞抗体(如rituximab, alemtuzumab)的患者,因为其免疫原性很差,所以此类患者的流感疫苗接种应至少延迟 6 个月。尽管在接受强化化疗(例如急性白血病的诱导或巩固化疗)的患者,通常是应该避免使用灭活疫苗,但鉴于需要每年接种一次以防止流行的季节性流感病毒株,建议还是应该向此类患者接种流感灭活疫苗。此外还强烈建议对家庭成员和医院工作人员进行流感疫苗的接种。无论如何,都不建议在同一季节接种第二剂流感疫苗 。
全球流感疫苗分为不活化流感疫苗与活性减毒流感疫苗。但是,鉴于每年需要注射一次以防止流行的季节性流感病毒株,我们建议癌症患者每年注射灭活(不活化)流感疫苗。依台湾疾病管制署建议,建议癌症病人施打流感疫苗。这些病人因接受各种肿瘤治疗,使得接受疫苗后产生抗体能力较差,但此类病人是发生流感并发症的高风险族群,因此仍建议以施打不活化的流感疫苗。
如果癌症病人接受近年最热门的免疫检查点抑制剂 (Immune checkpoint inhibitors,ICIs) 治疗,能否施打流感疫苗呢?因学理上ICIs 治疗会增强 T 细胞活性,且动物实验发现接受流感疫苗后使用 ICIs ,可能会增加免疫治疗相关的不良反应。而一个瑞士的小型研究,发现肺癌病人接受流感疫苗后,ICIs 治疗所产生免疫治疗相关的不良反应比例高达 52%, 且第三、四级免疫治疗相关的不良反应达26.1%,都比一般报导免疫治疗相关的不良反应比例高出甚多。但依据一篇最新研究,利用病例回溯统计接受免疫治疗的各式癌症病人,于两个月内曾接受流感疫苗注射,其免疫治疗出现免疫治疗相关的不良反应的比例,未发现有增加的情形,.且未发生严重级的免疫治疗相关的不良反应,如:心肌炎或脑炎。因此,美国 ACIP 仍建议使用免疫检查点抑制剂治疗的癌症病人,应该还是要接受不活化的流感疫苗。
l B型肝炎疫苗
对于要求药接种B型肝炎疫苗的癌症患者(无论他们是否有罹患B型肝炎的风险因素)以及所有有任何B型肝炎风险因素的未接种疫苗的癌症患者,都应该接种B型肝炎疫苗,但还是要提醒的是与其他疫苗一样,癌症患者和 接受造血干细胞的移植者可能对B型肝炎疫苗的反应不佳。
l A型肝炎疫苗
有任何罹患A型肝炎风险因素的癌症患者应该要接种A型肝炎疫苗,可以与B型肝炎疫苗联合接种,因为A型肝炎和B型肝炎的许多风险因素重迭。如上所述,疫苗效力在癌症患者中可能会受到影响。
l COVID-19 疫苗
癌症患者通常建议要接种 2019 年冠状病毒病 (COVID-19) 疫苗。尽管 COVID-19 疫苗对接受化疗和使用其他免疫治疗患者的免疫原性和疗效尚不确定,但对大多数人来说,COVID-19疫苗接种的潜在益处是超过这些不确定性。
l 带状疱疹疫苗
美国免疫实践咨询委员会 (ACIP) 建议 :针对50 岁以上免疫功能正常的个体,应该建议要接种带状疱疹疫苗。尽管美国食品和药物管理局已经核准重组带状疱疹疫苗 (RZV) 可以用于 18 岁以上免疫功能低下的个体,但 ACIP 尚未建议此一疫苗也可以用于中度至高度免疫功能低下的宿主,例如罹患有癌症。
对于所有患者,重组带状疱疹疫苗会优于减毒带状疱疹疫苗。目前带状疱疹疫苗禁止使用于正在接受中至高剂量会导致免疫抑制的抗癌治疗的患者,例如癌症化疗时。
血液系统恶性肿瘤和实体癌的患者罹患带状疱疹的会风险增加 ,发病率因癌症类型和治疗而异。霍奇金氏淋巴瘤病患者发生带状疱疹的风险特别高,患病或治疗期间的发生率接近 30%。
已经有研究证明接种重组带状疱疹疫苗,可以有效引发实体癌和血液癌患者针对带状疱疹的体液和细胞介导的免疫反应。在一项随机试验中,262 名超过18岁的实体瘤患者,分别在化疗前或化疗期间接受了重组带状疱疹疫苗(两次注射,间隔一到两个月)或安慰剂,发现重组带状疱疹疫苗是安全且具有免疫原性的;且接种重组带状疱疹疫苗一年后,体液和细胞介导的免疫反应均持续存在。尽管所有接受 重组带状疱疹疫苗的患者都产生了体液免疫反应,但与在化疗期间接种疫苗的患者相比,在化疗开始前接种疫苗的患者俱有更高的免疫保护力反映。在一项随机试验中,569 名 18 岁以上的血液系统恶性肿瘤患者,分别接受了重组带状疱疹疫苗(两次给药,间隔一到两个月)与安慰剂相比,80.4% 的疫苗接种组对带状疱疹产生了体液免疫反应,而 0.8%在未接种疫苗的组中,追踪13 个月的免疫反应仍然持续。两组之间没有检测到不良事件的差异。目前没有足够的数据来推荐重复剂量的重组带状疱疹疫苗,最终可能对血液系统恶性肿瘤与实体瘤恶性肿瘤患者有不同的建议。
总之目前建议于在肿瘤诊断和治疗之前已经有接受过 减毒带状疱疹疫苗的个体,建议改接种重组带状疱疹疫苗。其实等到患者完成化疗再接种带状疱疹疫苗可能是合理的,前提是他们没有同时接受其他中到高剂量的免疫抑制疗法。减毒带状疱疹疫苗对于以前接种过疫苗的老年癌症患者仍然有效。在一项针对实体瘤接受骨髓抑制性化疗的 60 岁以上个体,其中有 4710 未之前接受过减毒带状疱疹疫苗,其中 16,766为未接受过的队列研究,发现之前接种过疫苗的个体罹患带状疱疹的调整风险比为 0.58,而没有接种疫苗和六名未接种疫苗的患者因带状疱疹住院。
曾经报导有一名 79 岁的慢性淋巴细胞白血病男性出现疫减毒带状疱疹疫苗苗衍生的播散性水痘带状疱疹感染的致命病例,他在完成fludarabine, cyclophosphamide, a和 rituximab的六个疗程后的六个月才接受了减毒带状疱疹疫苗,ˇ能因为fludarabine、 rituximab治疗的长期免疫效应以及他的高龄可能使该患者易发生播散性感染。
目前接种的活性疫苗项目条列如下:
² 腺病毒疫苗
² 卡介苗
² 减毒活流感疫苗(鼻内)*
² 减毒口服脊髓灰质炎病毒活疫苗*
² 麻疹、腮腺炎和风疹疫苗
² 麻疹、腮腺炎、风疹和水痘疫苗
² 麻疹疫苗
² 腮腺炎疫苗
² 口服伤寒疫苗*
² 轮状病毒疫苗
² 德国麻疹疫苗
² 天花疫苗
² 水痘疫苗
² 黄热病疫苗
² 带状疱疹疫苗活性疫苗(但欣克疹Shingrix 带状疱疹疫苗属于非活性、有添加佐剂之基因重组疫苗)
关于癌友可能需要接种的活性疫苗,我们再来复习一下:
2013 年美国免疫实践咨询委员会 (ACIP) 建议指出,严重免疫功能低下患者当暴露于麻疹的应该接受 400 mg/kg 的静脉注射免疫球蛋白,无论先前的疫苗接种或免疫状态如何。而严重免疫功能低下的癌症患者,包括急性淋巴细胞白血病接受治疗直至完成治疗至少六个月的患者。
由于水痘疫苗很少会造成传染,因此易感家庭和癌症患者的其他密切接触者可以接种将水痘疫苗。如果家庭接触者在接种疫苗后出现皮疹,则家庭接触者应避免直接接触免疫功能低下的癌症患者。
一项研究评估了水痘疫苗对于白血病治疗后处于缓解期儿童的疗效。第一次和第二次接种后的血清抗体转化率分别为 88% 和 98%。几乎没有副作用,根据这项研究,在完成化疗后接种水痘疫苗对于易感的成年肿瘤患者进行免疫保护是合理的。
据报导,一名罹患有复发性弥漫性大 B 细胞淋巴瘤的成人在自体造血干细胞移植后4 年接种疫苗,因水痘疫苗的活化病毒导致了播散性致命感染;该患者虽已多年未接受化疗,但后来追查其腹部出现新的淋巴结,证实是弥漫性大 B 细胞淋巴瘤复发。
最后的总结和建议
² 对于越来越多的免疫力低下的患者来说,尤其是癌友,感染的预防确实是至关重要。这些患者的感染通常会导致过高的发病率和死亡率,并且抗感染治疗的疗效通常不如免疫力未受损的健康者有效。
² 虽然接种疫苗似乎是预防感染的具体方法,但许多免疫力受损的患者无法因疫苗接种而主动产生确切的保护性免疫反应。此外,多免疫力受损的患者进行活性病毒疫苗接种可能导致减毒活化而不受控制地增殖。
² 对于成年癌症患者,所有符合适应症的疫苗均应该在化疗、其他免疫抑制药物前、放疗治疗开始前或脾脏切除术前给予。符合适应症的灭活疫苗应在化疗前至少2 周前给予,符合适应症的活性病毒疫苗应在化疗前至少4 周给予。
² 原则上,接受化疗或其他免疫抑制治疗的癌症患者不应该接种活性疫苗。目前已有的活性减毒疫苗包括卡介苗(BCG)、水痘疫苗(Varicella)、麻疹腮腺炎德国麻疹混合疫苗(MMR)、黄热病疫苗(Yellow fever)、轮状病毒疫苗(Rota)、口服小儿麻痹疫苗(OPV)、日本脑炎疫苗(JE)等。白血病、淋巴瘤或其他恶性肿瘤患者,其疾病处于缓解期,未接受过抗 B 细胞抗体(如利妥昔单抗、阿仑单抗),且化疗已终止至少三个月,可以接受活病毒疫苗,例如根据年龄特定的建议接种麻疹、腮腺炎、风疹和水痘疫苗。对于已接受抗 B 细胞抗体的患者,灭活疫苗和活疫苗的接种应至少推迟六个月。
#癌症病患疫苗
#疫苗接种时间
#肺炎链球菌结合疫苗
#带状疱疹疫苗#流感疫苗
#新冠疫苗#水痘疫苗
#破伤风疫苗
#白喉疫苗
#百日咳疫苗
#感冒噬血杆菌疫苗
文献参考:
- Hibberd PL, Rubin RH. Approach to immunization in the immunosuppressed host. Infect Dis Clin North Am 1990; 4:123.
- Rubin LG, Levin MJ, Ljungman P, et al. 2013 IDSA clinical practice guideline for vaccination of the immunocompromised host. Clin Infect Dis 2014; 58:e44.
- Kroger AT, Duchin J, Vázquez M. General best practice guidelines for immunization. Best practices guidance of the Advisory Committee on Immunization Practices (ACIP). https://www.cdc.gov/vaccines/hcp/acip-recs/general-recs/index.html(Accessed on July 07, 2017).
- Hamarström V, Pauksen K, Svensson H, et al. Tetanus immunity in patients with hematological malignancies. Support Care Cancer 1998; 6:469.
- van der Does-van den Berg A, Hermans J, Nagel J, van Steenis G. Immunity to diphtheria, pertussis, tetanus, and poliomyelitis in children with acute lymphocytic leukemia after cessation of chemotherapy. Pediatrics 1981; 67:222.
- Task Force on Community Preventive Services. Strategies for reducing exposure to environmental tobacco smoke, increasing tobacco-use cessation, and reducing initiation in communities and health-care systems. A report on recommendations of the Task Force on Community Preventive Services. MMWR Recomm Rep 2000; 49:1.
- Centers for Disease Control and Prevention (CDC). Use of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine for adults with immunocompromising conditions: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep 2012; 61:816.
- Andersen MA, Niemann CU, Rostgaard K, et al. Differences and Temporal Changes in Risk of Invasive Pneumococcal Disease in Adults with Hematological Malignancies: Results from a Nationwide 16-Year Cohort Study. Clin Infect Dis 2021; 72:463.
- Addiego JE Jr, Ammann AJ, Schiffman G, et al. Response to pneumococcal polysaccharide vaccine in patients with untreated Hodgkin’s disease. Children’s Cancer Study Group Report. Lancet 1980; 2:450.
- Frederiksen B, Specht L, Henrichsen J, et al. Antibody response to pneumococcal vaccine in patients with early stage Hodgkin’s disease. Eur J Haematol 1989; 43:45.
- Donaldson SS, Vosti KL, Berberich FR, et al. Response to pneumococcal vaccine among children with Hodgkin’s disease. Rev Infect Dis 1981; 3 Suppl:S133.
- Siber GR, Gorham C, Martin P, et al. Antibody response to pretreatment immunization and post-treatment boosting with bacterial polysaccharide vaccines in patients with Hodgkin’s disease. Ann Intern Med 1986; 104:467.
- Ammann AJ, Schiffman G, Addiego JE, et al. Immunization of immunosuppressed patients with pneumococcal polysaccharide vaccine. Rev Infect Dis 1981; 3 Suppl:S160.
- Siber GR, Schur PH, Aisenberg AC, et al. Correlation between serum IgG-2 concentrations and the antibody response to bacterial polysaccharide antigens. N Engl J Med 1980; 303:178.
- Feldman S, Malone W, Wilbur R, Schiffman G. Pneumococcal vaccination in children with acute lymphocytic leukemia. Med Pediatr Oncol 1985; 13:69.
- Chan CY, Molrine DC, George S, et al. Pneumococcal conjugate vaccine primes for antibody responses to polysaccharide pneumococcal vaccine after treatment of Hodgkin’s disease. J Infect Dis 1996; 173:256.
- French N, Gordon SB, Mwalukomo T, et al. A trial of a 7-valent pneumococcal conjugate vaccine in HIV-infected adults. N Engl J Med 2010; 362:812.
- Advisory Committee on Immunization Practices. Summary Report, February 22-23, 2012. http://www.cdc.gov/vaccines/recs/acip/downloads/min-feb12.pdf(Accessed on June 25, 2012).
- Cohn AC, MacNeil JR, Clark TA, et al. Prevention and control of meningococcal disease: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 2013; 62:1.
- Taplitz RA, Kennedy EB, Bow EJ, et al. Antimicrobial Prophylaxis for Adult Patients With Cancer-Related Immunosuppression: ASCO and IDSA Clinical Practice Guideline Update. J Clin Oncol 2018; 36:3043.
- Grohskopf LA, Alyanak E, Ferdinands JM, et al. Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices, United States, 2021-22 Influenza Season. MMWR Recomm Rep 2021; 70:1.
- Meerveld-Eggink A, de Weerdt O, van der Velden AMT, et al. Response to influenza virus vaccination during chemotherapy in patients with breast cancer. Ann Oncol 2011; 22:2031.
- Wumkes ML, van der Velden AM, Los M, et al. Serum antibody response to influenza virus vaccination during chemotherapy treatment in adult patients with solid tumours. Vaccine 2013; 31:6177.
- Ortbals DW, Liebhaber H, Presant CA, et al. Influenza immunization of adult patients with malignant diseases. Ann Intern Med 1977; 87:552.
- Keam B, Kim MK, Choi Y, et al. Optimal timing of influenza vaccination during 3-week cytotoxic chemotherapy cycles. Cancer 2017; 123:841.
- Elting LS, Whimbey E, Lo W, et al. Epidemiology of influenza A virus infection in patients with acute or chronic leukemia. Support Care Cancer 1995; 3:198.
- Gribabis DA, Panayiotidis P, Boussiotis VA, et al. Influenza virus vaccine in B-cell chronic lymphocytic leukaemia patients. Acta Haematol 1994; 91:115.
- Anderson H, Petrie K, Berrisford C, et al. Seroconversion after influenza vaccination in patients with lung cancer. Br J Cancer 1999; 80:219.
- Brydak LB, Całbecka M. Immunogenicity of influenza vaccine in patients with hemato-oncological disorders. Leuk Lymphoma 1999; 32:369.
- Lo W, Whimbey E, Elting L, et al. Antibody response to a two-dose influenza vaccine regimen in adult lymphoma patients on chemotherapy. Eur J Clin Microbiol Infect Dis 1993; 12:778.
- Ljungman P, Nahi H, Linde A. Vaccination of patients with haematological malignancies with one or two doses of influenza vaccine: a randomised study. Br J Haematol 2005; 130:96.
- Beck CR, McKenzie BC, Hashim AB, et al. Influenza vaccination for immunocompromised patients: systematic review and meta-analysis by etiology. J Infect Dis 2012; 206:1250.
- Yri OE, Torfoss D, Hungnes O, et al. Rituximab blocks protective serologic response to influenza A (H1N1) 2009 vaccination in lymphoma patients during or within 6 months after treatment. Blood 2011; 118:6769.
- Markowitz LE, Dunne EF, Saraiya M, et al. Quadrivalent Human Papillomavirus Vaccine: Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 2007; 56:1.
- Mast EE, Weinbaum CM, Fiore AE, et al. A comprehensive immunization strategy to eliminate transmission of hepatitis B virus infection in the United States: recommendations of the Advisory Committee on Immunization Practices (ACIP) Part II: immunization of adults. MMWR Recomm Rep 2006; 55:1.
- Dooling KL, Guo A, Patel M, et al. Recommendations of the Advisory Committee on Immunization Practices for Use of Herpes Zoster Vaccines. MMWR Morb Mortal Wkly Rep 2018; 67:103.
- US Food and Drug Administration. Shingrix. https://www.fda.gov/media/108597/download(Accessed on August 02, 2021).
- Rusthoven JJ, Ahlgren P, Elhakim T, et al. Varicella-zoster infection in adult cancer patients. A population study. Arch Intern Med 1988; 148:1561.
- Wilson JF, Marsa GW, Johnson RE. Herpes zoster in Hodgkin’s disease. Clinical, histologic, and immunologic correlations. Cancer 1972; 29:461.
- Vink P, Delgado Mingorance I, Maximiano Alonso C, et al. Immunogenicity and safety of the adjuvanted recombinant zoster vaccine in patients with solid tumors, vaccinated before or during chemotherapy: A randomized trial. Cancer 2019; 125:1301.
- Dagnew AF, Ilhan O, Lee WS, et al. Immunogenicity and safety of the adjuvanted recombinant zoster vaccine in adults with haematological malignancies: a phase 3, randomised, clinical trial and post-hoc efficacy analysis. Lancet Infect Dis 2019; 19:988.
- Tseng HF, Tartof S, Harpaz R, et al. Vaccination against zoster remains effective in older adults who later undergo chemotherapy. Clin Infect Dis 2014; 59:913.
- Costa E, Buxton J, Brown J, et al. Fatal disseminated varicella zoster infection following zoster vaccination in an immunocompromised patient. BMJ Case Rep 2016; 2016.
- Kaplan LJ, Daum RS, Smaron M, McCarthy CA. Severe measles in immunocompromised patients. JAMA 1992; 267:1237.
- McLean HQ, Fiebelkorn AP, Temte JL, et al. Prevention of measles, rubella, congenital rubella syndrome, and mumps, 2013: summary recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 2013; 62:1.
- Grossberg R, Harpaz R, Rubtcova E, et al. Secondary transmission of varicella vaccine virus in a chronic care facility for children. J Pediatr 2006; 148:842.
- Gershon AA, Steinberg SP. Persistence of immunity to varicella in children with leukemia immunized with live attenuated varicella vaccine. N Engl J Med 1989; 320:892.
- Bhalla P, Forrest GN, Gershon M, et al. Disseminated, persistent, and fatal infection due to the vaccine strain of varicella-zoster virus in an adult following stem cell transplantation. Clin Infect Dis 2015; 60:1068.
- Centers for Disease Control and Prevention (CDC). Use of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine for adults with immunocompromising conditions: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep 2012;







