血液腫瘤科 陳駿逸醫師
大約60%的三陰性乳癌(TNBC)會有PI3K/Akt/mTOR訊號路徑發生異常的狀況,這個被活化的PI3K/Akt/mTOR路徑一直是研發治療三陰性乳癌的主要標靶。 PI3K/Akt/mTOR路徑與許多其他細胞訊號路徑相互作用,其失調與多種癌症的發生發展密切相關。
此路徑涉及一個訊號的級聯反應,首先是PI3K的激活,隨後是Akt和mTOR複合物的磷酸化活化。 mTOR複合物透過增強蛋白質合成、抑制細胞凋亡、擾亂自噬作用以及促進DNA修復來活化致癌過程,從而支持腫瘤細胞的存活。此外,PI3K/Akt/mTOR路徑在化療抗藥性的產生中扮演核心角色。多種改變(例如PIK3CA的活化突變或抑癌基因PTEN的缺失)都可能導致該路徑的過度活化。為了對抗這種失調,人們開發了針對PI3K、Akt和mTOR的標靶抑制劑。然而,多種癌症抗藥性機制的出現降低了這些藥物的療效,例如,mTOR阻斷後Akt的重新激活、胰島素信號通路對該通路的重新激活,或MAPK通路等補償通路的激活,從而限制了這些藥物在常規臨床實踐中的應用。為了克服這些抗藥性,目前正在臨床試驗中研究的聯合療法旨在改善PI3K/Akt/mTOR路徑抑制的臨床療效。本篇回顧旨在總結目前針對三陰性乳癌中該通路開發的治療方法,並著重於限制其療效的抗藥性機制。
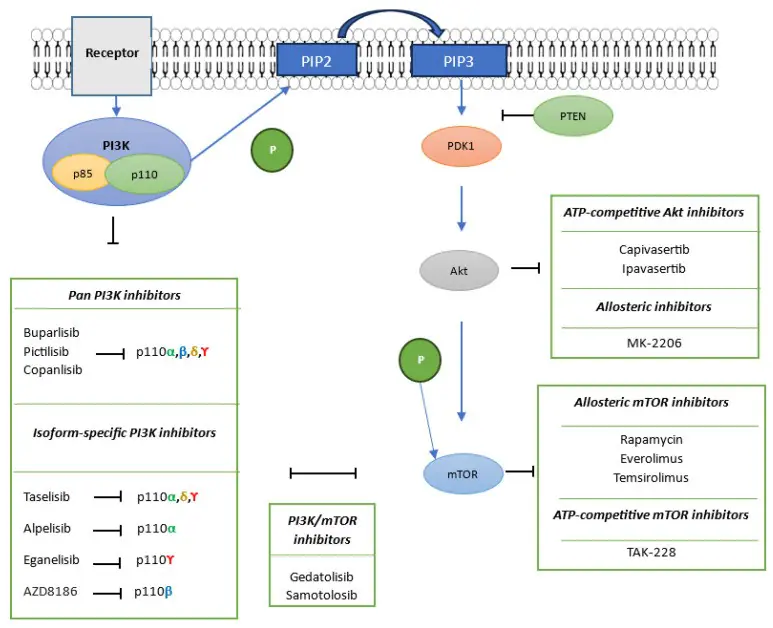
PI3K/Akt/mTOR訊號路徑及其在三陰性乳癌(TNBC)治療中的抑制劑。相應的受體會活化二聚體形式的PI3K(p85和p110亞基)。活化的PI3K將PIP2磷酸化為PIP3,進而活化Akt訊號級聯反應,Akt訊號級聯反應反過來磷酸化mTOR。 PTEN是此訊息傳遞路徑的主要天然抑制劑,作用於PDK1的上游。 PI3K抑制劑包括泛PI3K抑制劑(如buparlisib、pictilisib和copanlisib)和亞型特異性PI3K抑制劑(如taselisib、alpelisib和eganelisib)。 Akt抑制劑分為ATP競爭性抑制劑(如capivasetib和ipavasertib)和變構抑制劑(如MK-2206)。 mTOR抑制劑分為變構抑制劑(雷帕黴素、everolimus和temsirolimus)和ATP競爭性抑制劑(TAK-228)。此外,PI3K/mTOR抑制劑的代表藥物包括gedatolisib和samotolisib。
三陰性乳癌中出現PI3K/Akt/mTOR訊號路徑的改變
PI3K/Akt/mTOR 訊號路徑的主要改變包括 PI3K 基因的活化突變和 PTEN 基因的下調,這兩者都會導致該路徑的被過度活化。在三陰性乳癌 中,PIK3CA 突變發生率為 10.2%,其中以表達雄性激素受體(LAR) 之三陰性乳癌亞型的突變頻率最高 (46.2%) ,高於其他亞型 (4.5%)。
約 80% 的 PIK3CA 體細胞突變涉及三個熱點突變,每個突變影響一個胺基酸。位於外顯子 9(解旋酶結構域)的 E542K 和 E545K 會破壞與 p85 調節亞基 SH2 結構域的相互作用。位於外顯子 20(激酶結構域)的 H1047R 會上調下游 PI3K 訊號蛋白的活化。 p85α亞基的突變雖然較少見,但也能活化PI3K路徑。此外,PIK3CA基因的擴增可導致該路徑的等位基因劑量依賴性活化。
Akt1 E17K的熱點突變則是最常見的Akt基因相關的突變,它促進Akt1與PIP3結合並刺激其活化。儘管Akt1突變在三陰性乳癌並不常見(約3%),但在表達雄性激素受體的三陰性乳癌(LAR)中更為常見。
針對三陰性乳癌PI3K/Akt/mTOR訊號路徑的標靶治療
- PI3K 抑制劑
PI3K 抑制劑分為:泛 PI3K 抑制劑和亞型特異性抑制劑。泛 PI3K 抑制劑標靶 p110 亞基的所有亞型。
- Akt 抑制劑
Akt 抑制劑分為 ATP 競爭性抑制劑和變構的抑制劑,目前正在開發將其用於克服 三陰性乳癌的化療抗藥性。
- mTOR 抑制劑
變構 mTOR 抑制劑-rapamycin及其類似物(例如:everolimus和temsirolimus)會特異性抑制 mTORC1。
4.雙重PI3K/mTOR抑制劑
mTOR和PI3K的結構分析揭示了它們催化酶結構域的相似性,從而開發出雙重PI3K/mTOR抑制劑,以克服由補償性反饋環路和通路串擾介導的抗藥性機制。例如:Gedatolisib
合併PI3K/Akt/mTOR路徑抑制劑的標靶治療
對標靶PI3K/Akt/mTOR路徑抗藥性機制的療法研究,促使人們開發合併PI3K/Akt/mTOR路徑的標靶治療策略,以增強其療效。Gedatolisib (PKI-587) 是一種強效可逆的雙重抑制劑,可選擇性靶向所有 I 類 PI3K 亞型和 mTOR。
PI3K 訊號通路具有免疫抑制的作用,包括 PTEN 缺失相關的 PD-L1 表達會增加、以及會讓髓源性抑制細胞 (MDSC) 和調節性 T 細胞 (Treg) 發生募集。
將 PI3K/AKT/mTOR 抑制劑與免疫療法聯合應用可以逆轉治療抗藥性。 PI3K/mTOR 雙重抑制劑 gedatolisib 與免疫檢查點抑制劑具有協同作用,可增強腫瘤生長抑制,並提高 T 細胞、自然殺手 (NK) 細胞和樹突狀細胞 (DC) 的活化程度。
PI3K/Akt/mTOR路徑的抑制劑與PARP抑制劑合併用藥的治療策略
臨床前研究已證實PI3K抑制劑與PARP抑制劑之間是存在協同的作用。 PI3K抑制可以降低BRCA1表現、並損害核苷酸合成,而這兩者對於DNA修復均是至關重要。基於這些發現,一項納入26例乳癌患者(包括14例三陰性乳癌)的I期臨床研究(NCT01623349)。目的在評估PI3K抑制劑buparlisib與PARP抑制劑olaparib合併用藥的療效。結果顯示,5例(28%)患者腫瘤達到部分緩解,8例(44%)患者病情穩定超過6個月,顯示此與PARP抑制劑合併用藥的治療具有良好的應用前景。
此外,AKT抑制劑與標靶DNA修復路徑(尤其是PARP抑制劑)的藥物聯合應用被認為是一種潛在的治療方法。這種聯合療法有望提高基因不穩定腫瘤的治療效果,並克服某些惡性腫瘤的抗藥性。未來,AKT抑制劑與PARP抑制劑的合併應用可能成為多種惡性腫瘤(包括乳癌和卵巢癌)的潛在治療策略。這些聯合療法的應用範圍將超越化療藥物,涵蓋免疫療法和其他標靶藥物,從而增強AKT抑制劑的臨床療效。
PI3K/Akt/mTOR路徑的抑制劑與Eribulin合併用藥的治療策略
如前所述,臨床前研究已證實Eribulin與everolimus或PI3K抑制劑copanlisib在三陰性乳癌的細胞株中具有協同的作用。這些發現促成了1期臨床試驗NCT02120469的開展,該試驗評估了Eribulin合併everolimus的療效,結果顯示中位無惡化存活期為2.6個月,提示療效是很有限的。目前正在進行I/II期臨床試驗NCT04345913,該試驗目的在評估copanlisib合併Eribulin治療轉移性三陰性乳癌患者的療效,據我們所知,尚未公佈任何結果。
PI3K/Akt/mTOR路徑的抑制劑合併白蛋白紫杉醇±免疫療法
Ib期研究NCT03800836評估了ipatasertib/atezolizumab/paclitaxel或nab-paclitaxel治療局部晚期或轉移性三陰性乳癌患者的療效和安全性。ipatasertib與抗PD-L1免疫檢查點抑制劑藥物合併使用的理論依據是,AKT抑制劑會恢復腫瘤微環境中的T細胞功能,並促進具有幹細胞樣表型的記憶細胞的擴增。因此,ipatasertib可以透過維持記憶T細胞的幹細胞樣表型來增強免疫檢查點抑制劑的療效,從而促進患者癌症的長期緩解。接受白蛋白紫杉醇治療的患者中,中位無惡化存活期為6.6個月,接受太平洋紫杉醇治療的患者中位無惡化存活期為7.2個月。根據PIK3CA/Akt/PTEN基因改變狀態進行亞組的分析,結果顯示兩組間無明顯差異:PIK3CA/Akt/PTEN基因改變患者的中位無惡化存活期為7.4個月,而無此類基因改變患者的中位無惡化存活期為6.6個月。
PI3K/Akt/mTOR路徑的抑制劑與雄性素受體抑制劑合併用藥的策略
臨床前數據表明,雄性素受體陽性(LAR)之三陰性乳癌,會對 PI3K 抑制劑和 AR 拮抗劑更為敏感。基於這些發現,進行了 Ib/II 期 TBCR032 試驗 (NCT02457910),研究目的在比較enzalutamide單藥治療或 4 mg taselisib 治療雄性素受體呈現陽性之三陰性乳癌患者的療效。管腔雄性素受體亞型患者的中位無惡化存活期會比較佳(4.6 個月 vs 2.0 個月),提示此策略可能對該分子亞型患者有益。
結論與展望:
PI3K/Akt/mTOR訊號路徑是重要的腫瘤訊號通路,參與多種的致癌過程,包括細胞增殖、遷移和凋亡抑制。其在化療抗藥性中也發揮著核心的作用,尤其是在對傳統細胞毒殺性化療的抗藥性方面。特別是,在大多數三陰性乳癌病例中,該PI3K/Akt/mTOR訊號路徑處於過度活化狀態,這主要是由PIKCA和AKT1的活化突變以及PTEN的功能缺失性改變所致。這些改變導致侵襲性癌症表型,並與不良的臨床預後有相關。
這使得PI3K/Akt/mTOR路徑成為標靶治療開發的首要靶標。因此,人們開發了多種PI3K、Akt、mTOR以及雙重PI3K/mTOR抑制劑。然而,儘管臨床前的研究結果令人鼓舞,但這些藥物的毒性較高,會嚴重影響患者的依從性。此外,由於三陰性乳癌的分子異質性極高,出現了多種分子的抗藥性機制,涉及MAPK或Wnt等補償性的訊號路徑。這些因素會導致上述這些適應症迄今的臨床療效有限。
為了更好地理解該訊號通路及其異質性,一些新興技術正在不斷地湧現。例如,類器官技術能夠更好地的披露此訊息傳遞路徑活化對細胞的影響。空間轉錄組學的技術則有助於我們識別癌症發展過程中特定元件的活化位點。
儘管如此,近年來癌症分子特徵的分析和診斷工具的進步正逐步推動聯合治療策略的發展,將PI3K/Akt/mTOR抑制劑與標靶間補償性訊號通路的療法結合。這些試驗的初步結果令人鼓舞,尤其是在PTEN功能缺失突變的三陰性乳癌患者中。雖然仍需要進行進一步研究並深入了解三陰性乳癌的分子機制,但這些結果為在精準醫療時代改善疾病的臨床療效帶來了希望。這也鼓勵臨床醫生進行以生物標記為導向、並根據新的生物學知識和治療的進展所進行調整的治療方案。
AKT 路徑中的突變,特別是 AKT1 中的 E17K 突變,在許多實體癌症中很常見,例如:乳癌、肺癌、攝護腺癌和胃腸道癌症。AKT1 (亦即E17K)的 突變會讓實體癌症的預後不良,可促進癌細胞的增殖和持續存在。 Gregory 等人最近的一項研究發現了一種靶向該突變的可逆共價性抑制劑,該抑制劑具有顯著的抗腫瘤活性,且對正常細胞的影響極小。這項進展為 AKT 突變型的癌症提供了一種標靶治療方法,並為進一步的抑制劑研究提供了指導。
#PI3K
#Akt
#mTOR
#三陰性乳癌
#E17K
#標靶治療
#基因檢測
#陳駿逸醫師
#台中市全方位癌症關懷協會
#ipatasertib
#taselisib
#alpelisib
#capivasetib
#everolimus
#temsirolimus
#gedatolisib
#samotolisib
#PD-L1
#免疫檢查點抑制劑
陳駿逸醫師醫療門診服務時段
https://mycancerfree.com/contact/
更多陳駿逸醫師的癌症衛教影片請連接https://www.youtube.com/@mycancerfree
更多腫瘤治療相關資訊 請連接”陳駿逸醫師 與你癌歸於好” https://mycancerfree.com